args[0]=message
args[1]=DB::DB::Message=HASH(0x53a1e00)
Re: Черная дыра
25.08.2013 23:56 | А.П. Васи
Если взять купюру и посмотреть на неё
под ультрафиолетовым излучением - вот
и я собственно не могу понять как и по какой
причине узоры на купюре в разных цветах,
причиной которому по аналогии
можно было отнести к реликтовому излучению
пространства.
---
\\\Материал из Википедии свободной энциклопедии
Флуоресценция


Флуоресце́нция (вариант: флюоресценция) физический процесс, разновидность люминесценции.
Флуоресценцией обычно называют излучательный переход возбужденного
состояния с самого нижнего синглетного колебательного уровня S1 в основное состояние S0. В общем случае флуоресценцией называют разрешенный по спину излучательный переход между двумя
состояниями одинаковой мультиплетности: между синглетными уровнями 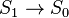 или триплетными
или триплетными  . Типичное
время жизни такого возбужденного
состояния составляет 10−11−10−6 с.
. Типичное
время жизни такого возбужденного
состояния составляет 10−11−10−6 с.
Флуоресценцию следует отличать от фосфоресценции запрещенного по спину излучательного перехода между двумя состояниями разной мультиплетности. Например, излучательный переход возбужденного триплетного состояния T1 в основное состояние S0. Синглет-триплетные переходы имеют квантово-механический запрет, поэтому время жизни возбужденного состояния при фосфоресценции составляет порядка 10−3−10−2 с.
\\\
\\\
Теоретические основы
Согласно представлениям квантовой химии, электроны в атомах расположены на энергетических уровнях. Расстояние между энергетическими уровнями в молекуле зависит от её строения. При облучении вещества светом возможен переход электронов между различными энергетическими уровнями. Разница энергии между энергетическими уровнями и частота колебаний поглощенного света соотносятся между собой уравнением (III постулат Бора):

После поглощения света часть полученной системой энергии расходуется в результате релаксации. Часть же может быть испущена в виде фотона определённой энергии.
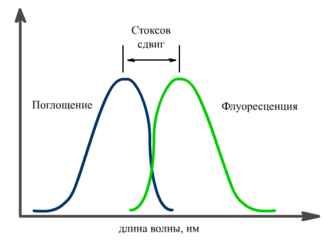
Соотношение спектров поглощения и флуоресценции
Спектр флуоресценции сдвинут относительно спектра поглощения в сторону длинных волн. Это явление получило название Стоксов сдвиг. Его причиной являются безызлучательные релаксационные процессы. В результате часть энергии поглощенного фотона теряется, а испускаемый фотон имеет меньшую энергию, и, соответственно, большую длину волны.[1]
Схематическое изображение процессов испускания и поглощения света. Диаграмма Яблонского
Схематически процессы поглощения света и флуоресценции показывают на диаграмме Яблонского.
При нормальных условиях большинство молекул находятся в основном электронном состоянии  . При поглощении света молекула переходит в возбужденное состояние
. При поглощении света молекула переходит в возбужденное состояние  .
При возбуждении на высшие электронные и колебательные уровни избыток
энергии быстро расходуется, переводя флуорофор на самый нижний
колебательный подуровень состояния
.
При возбуждении на высшие электронные и колебательные уровни избыток
энергии быстро расходуется, переводя флуорофор на самый нижний
колебательный подуровень состояния  . Однако, существуют и исключения:
например, флуоресценция азулена может происходить как из
. Однако, существуют и исключения:
например, флуоресценция азулена может происходить как из  ,
так и из
,
так и из  состояния.
состояния.
Квантовый выход флуоресценции
Квантовый выход флуоресценции показывает, с какой эффективностью проходит данный процесс. Он определяется как отношение количества испускаемых и поглощаемых фотонов. Квантовый выход флуоресценции может быть рассчитан по формуле

где 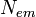 количество испускаемых в результате флуоресценции
фотонов, а
количество испускаемых в результате флуоресценции
фотонов, а 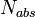 общее количество поглощаемых фотонов. Чем
больше квантовый выход флуорофора, тем интенсивнее его
флуоресценция. Квантовый выход можно также определить с помощью упрощенной диаграммы Яблонского[2],
где
общее количество поглощаемых фотонов. Чем
больше квантовый выход флуорофора, тем интенсивнее его
флуоресценция. Квантовый выход можно также определить с помощью упрощенной диаграммы Яблонского[2],
где 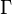 и
и 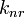 константы скорости излучательной и безызлучательной дезактивации возбужденного состояния.
константы скорости излучательной и безызлучательной дезактивации возбужденного состояния.
Тогда доля флуорофоров, возвращающихся в основное состояние с испусканием фотона, и, следовательно, квантовый выход:

Из последней формулы следует, что 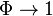 если
если
 ,
то есть если скорость безызлучательного перехода значительно меньше
скорости излучательного перехода. Отметим, что квантовый выход всегда
меньше единицы из-за стоксовых
потерь.\\\
,
то есть если скорость безызлучательного перехода значительно меньше
скорости излучательного перехода. Отметим, что квантовый выход всегда
меньше единицы из-за стоксовых
потерь.\\\
[Цитировать][Ответить][Новое сообщение]
| Форумы >> Обсуждение публикаций Астронета |
| Список / Дерево Заголовки / Аннотации / Текст |
- Черная дыра
(И. Д. Новиков, "Физика Космоса", 1986,
26.03.2003 20:16, 22.4 КБайт, ответов: 659)
1. Введение 2. Поле тяготения невращающейся черной дыры 3.... - Re: Черная дыра
(oliya Korobeinikova,
11.12.2010 20:41, 362 Байт, ответов: 3)
Привет всем!Писала... - Re[2]: Черная дыра
(с. а. вепрев,
16.12.2010 12:38, 738 Байт)
Если на Земле... - Re[2]: Черная дыра
(с. а. вепрев,
16.12.2010 12:38, 738 Байт)
Если на Земле... - Re[2]: Черная дыра
(Влад Логинов,
18.12.2010 21:58, 147 Байт)
А причем тут черная дыра и бермудский треугольник?... - Re: Черная дыра
(А. В. Рыков,
12.12.2010 15:34, 3.7 КБайт, ответов: 1)
Радиус чёрных дыр определяются... - Re[2]: Черная дыра
(В. В. Комогоров,
13.12.2010 20:38, 956 Байт)
Довольно странно, почему понятное триединство... - Re: Черная дыра
(Г. В. Фивейский,
23.12.2010 15:19, 270 Байт)
Каждая черная дыра имеет... - Re: Черная дыра
(Г. А. Зубков,
25.12.2010 1:36, 635 Байт)
товарищ Новиков пишет... - Re: Черная дыра
(А.П. Васи,
26.12.2010 15:31, 756 Байт, ответов: 1)
Г.А.Зубков"Почему... - Re[2]: Черная дыра
(А. В. Постников,
5.03.2016 14:41, 953 Байт)
- Re: Черная дыра
(А.П. Васи,
26.12.2010 15:43, 318 Байт)
Естественно вопрос возникает о единицах... - Re: Черная дыра
(Г. А. Зубков,
26.12.2010 21:48, 1.5 КБайт)
Чем ближе к центру гравитации... - Re: Черная дыра
(А.П. Васи,
27.12.2010 18:56, 1.5 КБайт, ответов: 1)
Г.А.ЗубковЯ смотрю... - Re[2]: Черная дыра
(Г. А. Зубков,
28.12.2010 21:38, 2.1 КБайт)
Ой,не смешите... - Re: Черная дыра
(А.П. Васи,
30.12.2010 0:24, 1019 Байт, ответов: 1)
Вы как и все астро... - Re[2]: Черная дыра
(Г. А. Зубков,
30.12.2010 9:34, 744 Байт)
Неприятно общаться с такими приблатнёнными негативистами,как вы.... - Re: Черная дыра
(А.П. Васи,
30.12.2010 17:53, 1.8 КБайт)
Я Вам культурно всё время... - Re: Черная дыра
(А.П. Васи,
30.12.2010 18:13, 507 Байт)
В астрономии кризис очень большой... - Re: Черная дыра
(А.П. Васи,
30.12.2010 18:29, 397 Байт)
Прочитайте 16 ответ, и другие... - Re: Черная дыра
(А.П. Васи,
30.12.2010 22:23, 911 Байт, ответов: 1)
Вы вот даже не знаете... - Re[2]: Черная дыра
(Г. А. Зубков,
31.12.2010 18:32, 1.9 КБайт)
Сфера,радиус чёрной дыры- понятие условное.... - Re: Черная дыра
(А.П. Васи,
31.12.2010 18:00, 571 Байт)
Да чуть не забыл... - Re: Черная дыра
(А.П. Васи,
31.12.2010 19:31, 2.2 КБайт)
"(если верить теории БВ)"о - Вы делаете успехи.... - Re: Черная дыра
(А.П. Васи,
1.01.2011 16:22, 1.0 КБайт)
Вот яркий пример когда модераторы... - Re: Черная дыра
(А.П. Васи,
1.01.2011 17:59, 1.2 КБайт)
""Вы полагаете... - Re: Черная дыра
(А.П. Васи,
1.01.2011 20:23, 1.4 КБайт, ответов: 1)
ВибеВы полагаете, что компьютер создавался без математической модели наблюдаемых явлений?... - Re[2]: Черная дыра
(Г. А. Зубков,
1.01.2011 21:21, 886 Байт)
Вас вообще наука интересует? Занимаетесь мелкими дрязгами,выяснением отношений.... - Re: Черная дыра
(А.П. Васи,
1.01.2011 22:18, 1.3 КБайт)
Вы уж извините... - Re: Черная дыра
(А.П. Васи,
2.01.2011 13:26, 189 Байт, ответов: 1)
Вот еще нашел "Предположение... - Re[2]: Черная дыра
(Г. А. Зубков,
3.01.2011 0:08, 708 Байт)
По последней ссылке прочитал такое... - Re: Черная дыра
(А.П. Васи,
3.01.2011 10:48, 2.8 КБайт)
Я не понимаю почему... - Re: Черная дыра
(А.П. Васи,
3.01.2011 11:52, 1.9 КБайт, ответов: 1)
Вы вот слишком узко смотрите... - Re[2]: Черная дыра
(Г. А. Зубков,
3.01.2011 16:36, 2.1 КБайт)
Вычислять взаимодействия между потоками эфира... - Re: Черная дыра
(А.П. Васи,
3.01.2011 17:25, 3.5 КБайт, ответов: 1)
"Вычислять взаимодействия между потоками... - Re[2]: Черная дыра
(Г. А. Зубков,
3.01.2011 23:16, 3.2 КБайт)
Насчёт электронов я читал такое... - Re: Черная дыра
(Г. А. Зубков,
4.01.2011 0:12, 253 Байт)
Уточнение: про Фотонную сферу пишет Натанзон Д.Д.... - Re: Черная дыра
(Г. А. Зубков,
4.01.2011 0:15, 253 Байт)
Уточнение: про Фотонную сферу пишет Натанзон Д.Д.... - Re: Черная дыра
(Г. А. Зубков,
4.01.2011 0:16, 253 Байт)
Уточнение: про Фотонную сферу пишет Натанзон Д.Д.... - Re: Черная дыра
(А.П. Васи,
4.01.2011 1:08, 1.3 КБайт, ответов: 1)
Вы я смотрю недопонимаете... - Re[2]: Черная дыра
(Г. А. Зубков,
4.01.2011 7:14, 1.7 КБайт)
Гравитация и клей- понятия слишком разные.... - Re: Черная дыра
(А.П. Васи,
4.01.2011 9:37, 1.4 КБайт)
Мне Ваши выдумки не интересны... - Re: Черная дыра
(А.П. Васи,
4.01.2011 10:27, 2.9 КБайт)
Я понимаю что можно докторскую... - Re: Черная дыра
(А.П. Васи,
5.01.2011 14:35, 1.9 КБайт, ответов: 1)
http://www.astronomy.ru/forum/index.php/topic,79788.msg1436797.html#msg1436797Вибе продолжает тупить... - Re[2]: Черная дыра
(Г. А. Зубков,
5.01.2011 19:34, 627 Байт)
К сожалению на этом форуме... - Re: Черная дыра
(А.П. Васи,
5.01.2011 20:55, 2.3 КБайт)
Вы в любом поисковике наберите Т.... - Re: Черная дыра
(А.П. Васи,
8.01.2011 11:41, 1.8 КБайт)
"чем больше... - Re: Черная дыра
(А.П. Васи,
16.01.2011 13:46, 1.5 КБайт)
По поводу... - Re: Черная дыра
(А.П. Васи,
16.01.2011 14:13, 656 Байт, ответов: 2)
Вот объяснить действия модератора-гандольера достаточно... - Re[2]: Черная дыра
(С. В. Семенов,
7.01.2013 10:26, 1.1 КБайт, ответов: 1)
Я-новичок. Весело у вас, ребята! А.П.... - Re[3]: Черная дыра
(Ю. С. Решников,
7.01.2013 12:42, 583 Байт)
Физики, что религиозные фанатики, религия которых - физика.... - Re: Черная дыра
(А.П. Васи,
16.01.2011 22:21, 1.7 КБайт)
Хоть я и увлекаюсь астрономией... - Re: Черная дыра как супер коллаедр
(L. L. luyko,
15.02.2011 14:47, 2.5 КБайт)
Начну... - Re: Черная дыра
(А.П. Васи,
16.04.2011 12:00, 968 Байт)
http://www.astronomy.ru/forum/index.php/topic,73830.msg1534675.html#msg1534675Модератора на атрофоруме... - Re: Черная дыра
(s. s. pogosyan,
17.04.2011 10:15, 232 Байт)
www.armonpogosyan.com В современной науке установленно... - Re: Черная дыра
(L. L. Li,
24.05.2011 6:20, 2.5 КБайт)
Уважаемые коллеги теоретики давайте разберёмся... - Re: Черная дыра
(s. s. pogosyan,
24.05.2011 10:32, 1.2 КБайт)
Уважаемый Л.Л.Л.,Сверхмассивные... - Re: Черная дыра
(А.П. Васи,
25.05.2011 9:38, 1.3 КБайт, ответов: 2)
\давайте разберёмся с ЧД которая... - Re[2]: Черная дыра
(М. Ю. Якимов,
25.05.2011 10:56, 1.1 КБайт, ответов: 1)
Прежде чем трепать, дорогой господин Васи, подумайте, как отмываться-то будете.... - Re[3]: Черная дыра
(М. Ю. Якимов,
25.05.2011 11:05, 539 Байт)
Внимание!К сожалению, приведенные... - Re: Черная дыра
(А.П. Васи,
25.05.2011 22:22, 11.4 КБайт, ответов: 1)
М.Ю.ЯкимовВы... - Re[2]: Черная дыра
(М. Ю. Якимов,
27.05.2011 8:00, 746 Байт)
А.П.Васи - ваше непонимание... - Re: Черная дыра
(А.П. Васи,
27.05.2011 9:27, 922 Байт)
М.Ю.ЯкимовВы или ответьте... - Re: Черная дыра
(А.П. Васи,
27.05.2011 10:11, 627 Байт)
М.Ю.ЯкимовВы определитесь зачем... - Re: Черная дыра
(А.П. Васи,
7.06.2011 20:14, 916 Байт)
http://www.astronomy.ru/forum/index.php/topic,85823.0.html\\\Дмитрий Вибе Модератор Тема закрыта.... - Re: Черная дыра
(А.П. Васи,
14.08.2011 11:47, 1.3 КБайт, ответов: 1)
http://www.astronomy.ru/forum/index.php/topic,76585.msg1641461.html#msg1641461Дмитрий Вибе продолжает давить на линию обсуждения.... - Re[2]: Черная дыра
(А.П. Васи,
14.08.2011 12:07, 3.1 КБайт)
Я лично вообще не понимаю... - Re: Черная дыра
(А. П. Иванов,
2.09.2011 13:29, 290 Байт, ответов: 1)
Я думаю что никаких чёрных дыр нету.... - Re[2]: Черная дыра
(В. В. Комогоров,
5.09.2011 16:13, 554 Байт)
Вопрос имеет образ, но как быть с определениями?... - Re: Черная дыра
(А.П. Васи,
17.09.2011 0:37, 1.0 КБайт)
Re: Гравитация наоборот. Теория гравитационных точек.... - Re: Черная дыра
(А.П. Васи,
17.09.2011 1:00, 544 Байт)
Парадигма даже причины скорости света... - Re: Черная дыра
(А.П. Васи,
17.09.2011 18:42, 1.0 КБайт, ответов: 1)
http://www.astronomy.ru/forum/index.php/topic,88376.msg1675230.html#msg1675230Цитата: гравицап... - Re[2]: Черная дыра
(А. С. Вишневский,
19.09.2011 3:13, 1.2 КБайт)
О, э - Re: Черная дыра
(А.П. Васи,
19.09.2011 12:14, 4.7 КБайт)
Оно таки очень удобно... - Re: Черная дыра
(А.П. Васи,
19.09.2011 12:38, 28.3 КБайт)
1 Некоторые сверхмассивные черные... - Re: Черная дыра
(А.П. Васи,
19.09.2011 15:51, 2.3 КБайт)
http://www.wikiznanie.ru/ru-wz/index.php/%D0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD-%D0%B2%D0%BE%D0%BB%D1%8C%D1%82Электронвольт единица измерения... - Re: Черная дыра
(А.П. Васи,
20.09.2011 10:05, 1.8 КБайт)
Ответ #4 : Сегодня... - Re: Черная дыра
(А.П. Васи,
20.09.2011 10:19, 952 Байт, ответов: 1)
Цитата: Che от Сегодня... - Re[2]: Черная дыра
(А.П. Васи,
30.10.2011 14:01, 2.2 КБайт)
С моей точки зрения основная... - Re: Черная дыра
(А.П. Васи,
25.11.2011 23:58, 1.6 КБайт)
\\\Цитата: Дмитрий... - Re: Черная дыра
(А.П. Васи,
26.11.2011 1:17, 1.1 КБайт)
Ответ... - Re: Черная дыра
(А.П. Васи,
30.11.2011 13:17, 3.4 КБайт)
Новая ситуация на форуме, участники... - Re: Черная дыра
(А.П. Васи,
30.11.2011 14:40, 3.8 КБайт)
\\\"вибёнок" И это обсуждение тоже останется незавершённым.... - Re: Черная дыра
(А.П. Васи,
30.11.2011 15:20, 687 Байт)
Посмотрел фильм понравился, как-бы фильм по астрофизике в художественном варианте.... - Re: Черная дыра
(А.П. Васи,
30.11.2011 15:46, 1.7 КБайт)
"вибенок"\\\Нет, конечно.... - Re: Черная дыра
(А.П. Васи,
30.11.2011 17:48, 1.7 КБайт)
\\\Цитата: lorein от Сегодня... - Re: Черная дыра
(А.П. Васи,
30.11.2011 20:08, 1.4 КБайт)
Мне жалко смотреть... - Re: Черная дыра
(А.П. Васи,
1.12.2011 0:42, 1.3 КБайт)
http://www.astronomy.ru/forum/index.php/topic,90464.msg1759427.html#msg1759427Гришин С. Г.... - Re: Черная дыра
(А.П. Васи,
2.12.2011 10:29, 744 Байт)
Гандольер вибёнок за деньги которые... - Re: Черная дыра
(А.П. Васи,
2.12.2011 10:42, 346 Байт)
Вибёнок - балласт науки.Который только... - Re: Черная дыра
(А.П. Васи,
2.12.2011 20:45, 288 Байт)
Как и следовало ожидать закрыты оба форума.... - Re: Черная дыра
(А.П. Васи,
3.12.2011 16:57, 4.1 КБайт)
Re: Действительно ли скорость света в вакууме - инвариант?... - Re: Черная дыра
(А.П. Васи,
3.12.2011 17:02, 72 Байт)
http://www.sciteclibrary.ru/cgi-bin/yabb2/YaBB.pl?num=1319091586/390#390 - Re: Черная дыра
(А.П. Васи,
14.12.2011 10:57, 1.4 КБайт)
Эксперимент Александрова... - Re: Черная дыра
(А.П. Васи,
18.12.2011 20:12, 959 Байт)
Вот думал про опыт Александрова... - Re: Черная дыра
(А.П. Васи,
25.12.2011 17:17, 2.6 КБайт)
На популярной кинематике меня забанили... - Re: Черная дыра
(А.П. Васи,
17.01.2012 1:13, 2.0 КБайт)
РассказФантастический сон о городе физиков.... - Re: Черная дыра
(А.П. Васи,
17.01.2012 1:43, 1.8 КБайт)
ПродолжениеРассказФантастический сон о городе физиков.... - Re: Черная дыра
(О. Е. Коробейникова,
24.01.2012 22:04, 1.1 КБайт)
Как писалГермес Трисменист:"... - Re: Черная дыра
(О. Е. Коробейникова,
4.02.2012 16:21, 31 Байт)
Спасибо!Что печатали мои посты. - Re: Черная дыра
(А.П. Васи,
4.02.2012 18:59, 816 Байт)
Вы больны фактически... - Re: Черная дыра
(О. Е. Коробейникова,
5.02.2012 22:49, 111 Байт)
Мне все равно,что Вы про меня пишете.... - Re: Черная дыра
(А.П. Васи,
6.02.2012 0:34, 802 Байт)
http://www.psyclinic.ru/page_36.html\\\Именно внезапность возникновения... - Re: Черная дыра
(А.П. Васи,
6.02.2012 22:27, 885 Байт)
Сегодня прочитал формулировку абсолютно противоречащую авторскому от Доплера.... - Re: Черная дыра
(А.П. Васи,
6.02.2012 22:30, 2.2 КБайт)
Учитывая что модераторы там периодически глупость удаляютСкопирую позор астрофизиков сюда.... - Re: Черная дыра
(А.П. Васи,
7.02.2012 2:47, 1.6 КБайт)
По черной дыре ещёhttp://siteua.org/system_category/330344... - Re: Черная дыра
(А.П. Васи,
7.02.2012 17:42, 2.2 КБайт)
http://www.popmech.ru/article/10479-dyira-kak-vyiklyuchatel/page/4/\\\Скорость рождения новых... - Re: Черная дыра
(А.П. Васи,
12.02.2012 15:35, 2.7 КБайт)
Ответ #154 : Вчера... - Re: Черная дыра
(А.П. Васи,
12.02.2012 16:24, 2.3 КБайт)
Всё равно слово фотон... - Re: Черная дыра
(А.П. Васи,
12.02.2012 16:31, 469 Байт)
Из предыдущего следует... - Re: Черная дыра
(А.П. Васи,
12.02.2012 19:24, 2.9 КБайт)
\\\Полагаю, закон Хаббла в рамках... - Re: Черная дыра
(А.П. Васи,
13.02.2012 2:12, 1.6 КБайт)
У модератора моск поплыл по полной, или старость своё берет.... - Re: Черная дыра
(А.П. Васи,
13.02.2012 2:29, 409 Байт)
И модератор забанил посетителя... - Re: Черная дыра
(А.П. Васи,
13.02.2012 16:46, 2.3 КБайт)
А теперь я посчитаю... - Re: Черная дыра
(О. Е. Коробейникова,
14.02.2012 19:58, 53 Байт)
Я дала ссылку на Ваш сайт.Ничего. На тему Созвездия.. - Re: Черная дыра
(А.П. Васи,
15.02.2012 22:56, 460 Байт)
http://elementy.ru/lib/430551Рисунок 1.... - Re: Черная дыра
(А.П. Васи,
15.02.2012 23:09, 804 Байт)
По большому счету астрофизику... - Re: Черная дыра
(А.П. Васи,
15.02.2012 23:18, 2.9 КБайт)
Ну ладно... - Re: Черная дыра
(А.П. Васи,
18.02.2012 2:11, 1.6 КБайт)
Смотрю что в практических вопросах... - Re: Черная дыра
(А.П. Васи,
18.02.2012 2:15, 183 Байт)
http://www.astronet.ru/db/forums/1244628"Свет и пространство и о скорости света.... - Re: Черная дыра
(А.П. Васи,
18.02.2012 12:58, 1.4 КБайт)
http://www.astronomy.ru/forum/index.php/topic,92644.msg1861215.html#msg1861215Цитата: Rudnik... - Re: Черная дыра
(А.П. Васи,
19.02.2012 15:10, 1.3 КБайт)
Слесарь-сантехник\\\Вот маятник - универсальный прибор... - Re: Черная дыра
(А.П. Васи,
19.02.2012 19:08, 817 Байт)
Ответ #233 : Сегодня... - Re: Черная дыра
(А.П. Васи,
24.02.2012 4:41, 932 Байт)
ЖПС задействовали для точности... - Re: Черная дыра
(А.П. Васи,
24.02.2012 23:40, 1.1 КБайт)
Эффект Вавилова Черенко́... - Re: Черная дыра
(А.П. Васи,
26.02.2012 2:52, 1.4 КБайт)
Цитата: Хворостенко от Вчера... - Re: Черная дыра
(А.П. Васи,
26.02.2012 11:27, 14.1 КБайт)
Ответ #84 : Сегодня... - Re: Черная дыра
(А.П. Васи,
26.02.2012 11:45, 972 Байт)
Естественно со смехом вспоминается... - Re: Черная дыра
(А.П. Васи,
26.02.2012 12:03, 1.2 КБайт)
Вспомнился... - Re: Черная дыра
(А.П. Васи,
26.02.2012 12:20, 182 Байт)
http://physics.ru/courses/op25part2/content/chapter4/section/paragraph2/theory.html - Re: Черная дыра
(А.П. Васи,
26.02.2012 12:59, 1.5 КБайт)
Ответ... - Re: Черная дыра
(А.П. Васи,
26.02.2012 13:12, 1.0 КБайт)
Ответ... - Re: Черная дыра
(А.П. Васи,
26.02.2012 13:19, 2.5 КБайт)
А... - Re: Черная дыра
(А.П. Васи,
26.02.2012 13:21, 1.7 КБайт)
Ответ... - Re: Черная дыра
(А.П. Васи,
26.02.2012 13:24, 997 Байт)
Нет слов .--------------------------------------------------------------- Ответ... - Re: Черная дыра
(А.П. Васи,
26.02.2012 13:53, 1.3 КБайт)
Смеялся, ибо математик занимающийся физикой... - Re: Черная дыра
(А.П. Васи,
28.02.2012 11:26, 598 Байт)
Вот это жестко астрономов сделали... - Re: Черная дыра
(Маша Ковалёва,
28.02.2012 12:05, 25 Байт)
Квазар - это Чёрная дыра? - Re: Черная дыра
(А.П. Васи,
28.02.2012 20:55, 10.4 КБайт)
Квазар лично для меня звезда... - Re: Черная дыра
(А.П. Васи,
29.02.2012 12:18, 6.2 КБайт)
\\\Квазар - это Чёрная дыра?\\\Учитывая... - Re: Черная дыра
(А.П. Васи,
29.02.2012 12:33, 916 Байт)
http://www.pravda.ru/science/eureka/hypotheses/29-02-2012/1109473-neitrino_falsh-0/\\\Однако позже выяснилось... - Re: Черная дыра
(А.П. Васи,
29.02.2012 14:10, 2.6 КБайт)
Вот если почитать что говорит... - Re: Черная дыра
(А.П. Васи,
29.02.2012 21:17, 1.2 КБайт)
Ответ #486 : Сегодня... - Re: Черная дыра
(А.П. Васи,
1.03.2012 14:12, 2.3 КБайт)
Ответ #511 : Сегодня... - Re: Черная дыра
(А.П. Васи,
1.03.2012 18:42, 1.9 КБайт)
Старый релятивист обхезался по полной... - Re: Черная дыра
(А.П. Васи,
15.03.2012 5:12, 986 Байт)
Re: Что такое инерция материального тела?... - Re: Черная дыра
(А.П. Васи,
18.03.2012 15:13, 3.6 КБайт)
Ответ #12 : Сегодня... - Re: Черная дыра
(А.П. Васи,
18.03.2012 21:06, 1.6 КБайт)
Ответ #227 : Сегодня... - Re: Черная дыра
(А.П. Васи,
20.03.2012 15:56, 902 Байт)
http://www.computerra.ru/own/wiebe/660411/\\\Солнечный ветер выдувает... - Re: Черная дыра
(А.П. Васи,
24.03.2012 17:55, 1.5 КБайт)
Редкий случай, адекватно рассуждающий человек... - Re: Черная дыра
(А. И. Неживых,
31.03.2012 21:08, 407 Байт)
В формуле чёрной... - Re: Черная дыра
(А.П. Васи,
4.04.2012 19:16, 1014 Байт)
[PDF] users.kpi.kharkov.ua/koef/Files/pr_c.files/Lab.../2.6_opt(Yung).pdf---------------------- ---------------------------Обсуждают героически ботаники на форуме.... - Re: Черная дыра
(А.П. Васи,
4.04.2012 19:22, 256 Байт)
Я вообще не понимаю зачем... - Re: Черная дыра
(А.П. Васи,
4.04.2012 19:34, 764 Байт)
http://msk.edu.ua/ivk/Fizika/Tushev_Shizika/TUSHEV2/18-2.html\\\Томас Юнг наблюдал... - Re: Черная дыра
(А.П. Васи,
4.04.2012 19:54, 456 Байт)
Итого опыт Томаса Юнга, - используются... - Re: Черная дыра
(А.П. Васи,
5.04.2012 13:33, 1.0 КБайт)
Цитата Хартиков Сергей... - Re: Черная дыра
(А.П. Васи,
5.04.2012 17:15, 2.4 КБайт)
и более идиотских и необоснованных... - Re: Черная дыра
(А.П. Васи,
6.04.2012 14:39, 1.5 КБайт)
Цитата: Kostyrko от Сегодня... - Re: Черная дыра
(А.П. Васи,
17.04.2012 16:33, 1.8 КБайт)
Рассмешил меня этот форум А если Большой взрыв - это заблуждение?... - Re: Черная дыра
(А.П. Васи,
20.04.2012 14:19, 2.4 КБайт)
Не понимаю на сколько... - Re: Черная дыра
(А.П. Васи,
24.04.2012 10:04, 2.1 КБайт)
Вот тоже яркий пример неадекватного... - Re: Черная дыра
(А.П. Васи,
24.04.2012 19:01, 2.6 КБайт)
http://www.sciteclibrary.ru/cgi-bin/yabb2/YaBB.pl?num=1334922693 СТО - АЦКАЯ ЖЕСТЬ... - Re: Черная дыра
(А.П. Васи,
24.04.2012 19:16, 816 Байт)
С технической точки зрения... - Re: Черная дыра
(А.П. Васи,
25.04.2012 22:31, 5.7 КБайт)
26032012119.jpg (181.9 КБ, 900x675 - просмотрено... - Re: Черная дыра
(А.П. Васи,
26.04.2012 14:25, 3.1 КБайт)
Сообщений: 2 684Рейтинг: +50/-16Suum сuiquе!... - Re: Черная дыра
(А.П. Васи,
26.04.2012 14:55, 2.0 КБайт)
Смешно,- большой взрыв важнее тепла... - Re: Черная дыра
(А.П. Васи,
29.04.2012 12:22, 1.8 КБайт)
Теоретические воззрения должны указывать... - Re: Черная дыра
(А.П. Васи,
29.04.2012 16:47, 2.3 КБайт)
Цитата: Foton58 от Сегодня... - Re: Черная дыра
(А.П. Васи,
29.04.2012 19:14, 13.0 КБайт)
Ответ #194 : Сегодня... - Re: Черная дыра
(А.П. Васи,
30.04.2012 3:28, 1.4 КБайт)
А ларчик просто открывался кое кто на своей волне залип.... - Re: Черная дыра
(А.П. Васи,
30.04.2012 13:41, 41.4 КБайт)
Ответ #186 : Сегодня... - Re: Черная дыра
(А.П. Васи,
30.04.2012 14:44, 595 Байт)
Для тех кто не понял... - Re: Черная дыра
(А.П. Васи,
30.04.2012 14:57, 4.5 КБайт)
Эволюция звёзд это в принципе нечто смешное.... - Re: Черная дыра
(А.П. Васи,
4.05.2012 22:00, 3.9 КБайт)
Модераторам задают однозначные вопросы... - Re: Черная дыра
(А.П. Васи,
5.05.2012 3:11, 2.2 КБайт)
Собственно модератор хотел перехитрить... - Re: Черная дыра
(А.П. Васи,
5.05.2012 14:58, 480 Байт)
Вопросы таки надо ставить корректно.Качественный вопрос.... - Re: Черная дыра
(А.П. Васи,
5.05.2012 16:35, 3.2 КБайт)
Модератор в очередной раз выглядит... - Re: Черная дыра
(А.П. Васи,
10.05.2012 15:13, 3.9 КБайт)
\\\ Ответ #241 : Вчера... - Re: Черная дыра
(А.П. Васи,
10.05.2012 15:27, 605 Байт)
Для тех кто не заметил... - Re: Черная дыра
(А.П. Васи,
16.05.2012 3:09, 3.9 КБайт)
Ответ #17 : Вчера... - Re: Черная дыра
(А.П. Васи,
16.05.2012 3:20, 353 Байт)
Для тех кто не понял... - Re: Черная дыра
(А.П. Васи,
25.05.2012 3:10, 2.0 КБайт)
Модератора гандольерит по самое дальше... - Re: Черная дыра
(А.П. Васи,
26.05.2012 0:19, 4.0 КБайт)
Ну что я говорил... - Re: Черная дыра
(А.П. Васи,
26.05.2012 0:35, 74 Байт)
http://www.kit-e.ru/articles/measure/2010_07_169.phpрис.23 - Re: Черная дыра
(А.П. Васи,
26.05.2012 1:48, 2.0 КБайт)
Ответ #65 : Вчера... - Re: Черная дыра
(А.П. Васи,
26.05.2012 9:39, 105 Байт)
Для тех кто не заметил... - Re: Черная дыра
(А.П. Васи,
26.05.2012 10:03, 1.2 КБайт)
Ответ #360 : Вчера... - Re: Черная дыра
(А.П. Васи,
27.05.2012 1:37, 5.3 КБайт)
Ответ #68 : Вчера... - Re: Черная дыра
(А.П. Васи,
31.05.2012 10:03, 2.5 КБайт)
Как я рад что не на форуме где модератор гандольер.... - Re: Черная дыра
(А.П. Васи,
31.05.2012 23:57, 1.8 КБайт)
Чтобы были понятны мечты некоторого... - Re: Черная дыра
(А.П. Васи,
27.06.2012 22:00, 2.3 КБайт)
\\\ Re: Поле и эфир Ответ... - Re: Черная дыра
(А.П. Васи,
11.07.2012 2:52, 3.7 КБайт)
Я опять на одном форуме... - Re: Черная дыра
(А.П. Васи,
24.07.2012 0:15, 2.4 КБайт)
Давече прочел очередную статью одного... - Re: Черная дыра
(А.П. Васи,
24.07.2012 0:23, 644 Байт)
\\\Соответственно если пылинка излучает... - Re: Черная дыра
(А.П. Васи,
24.07.2012 0:32, 1.4 КБайт)
Но есть ещё и третье... - Re: Черная дыра
(А.П. Васи,
24.07.2012 0:36, 168 Байт)
\\\РЕЗОНАНСНОЕ ИЗЛУЧЕНИЕ\\\http://dic.academic.ru/dic.nsf/enc_physics/4516/%D0%A0%D0%95%D0%97%D0%9E%D0%9D%D0%90%D0%9D%D0%A1%D0%9D%D0%9E%D0%95Ссылка. - Re: Черная дыра
(А.П. Васи,
25.07.2012 2:28, 743 Байт)
http://www.astronomy.ru/forum/index.php/topic,98240.0.htmlСмешна картина наблюдается... - Re: Черная дыра
(А.П. Васи,
25.07.2012 2:53, 447 Байт)
Я достаточно качественно анализировал... - Re: Черная дыра
(А.П. Васи,
25.07.2012 10:09, 1.7 КБайт)
А что я наблюдаю, плывёт... - Re: Черная дыра
(А.П. Васи,
25.07.2012 22:30, 2.1 КБайт)
Забанили барышню... - Re: Черная дыра
(А.П. Васи,
26.07.2012 9:16, 1.4 КБайт)
------------------------------------ Ответ #829 : Сегодня в 01:16:31 Цитата: Зубков Г.... - Re: Черная дыра
(В. А. Аксёнова,
26.07.2012 21:06, 159 Байт)
Я-абсолютный новичок на форуме..Недавно... - Re: Черная дыра
(А.П. Васи,
26.07.2012 21:39, 733 Байт)
Относитесь проще. Астрономия и астрономы... - Re: Черная дыра
(А.П. Васи,
26.07.2012 21:47, 424 Байт, ответов: 1)
Если есть время могу посоветовать... - Re[2]: Черная дыра
(В. А. Аксёнова,
26.07.2012 22:09, 28 Байт)
Да Вы прям Пелевин какой-то! - Re: Черная дыра
(А.П. Васи,
26.07.2012 22:48, 408 Байт)
Не думаю что качество... - Re: Черная дыра
(В. А. Аксёнова,
27.07.2012 11:24, 564 Байт)
Дело не в качестве,а во взглядах.... - Re: Черная дыра
(А.П. Васи,
27.07.2012 20:27, 28.3 КБайт)
Скажу Вам по секрету... - Re: Черная дыра
(А.П. Васи,
27.07.2012 20:32, 6.9 КБайт)
- Re: Черная дыра
(А.П. Васи,
27.07.2012 20:40, 5.3 КБайт)
Итого что имеем - есть большой... - Re: Черная дыра
(А.П. Васи,
27.07.2012 20:44, 2.6 КБайт)
- Re: Черная дыра
(А.П. Васи,
27.07.2012 20:46, 34.0 КБайт)
Более развёрнуто по черным дырам... - Re: Черная дыра
(А.П. Васи,
27.07.2012 21:44, 1.4 КБайт)
Вот как бывает небольшое высказывание а как нагнуло всех релятивистов.... - Re: Черная дыра
(А.П. Васи,
28.07.2012 13:25, 769 Байт)
В.А.Аксёнова... - Re: Черная дыра
(А.П. Васи,
28.07.2012 18:42, 3.2 КБайт)
- Re: Черная дыра
(А.П. Васи,
28.07.2012 18:47, 2.9 КБайт)
- Re: Черная дыра
(А.П. Васи,
28.07.2012 18:52, 635 Байт)
http://elementy.ru/lib/430551Рисунок 1.... - Re: Черная дыра
(А.П. Васи,
28.07.2012 18:57, 2.1 КБайт)
РассказФантастический сон о городе физиков.... - Re: Черная дыра
(А.П. Васи,
28.07.2012 18:57, 2.1 КБайт)
РассказФантастический сон о городе физиков.... - Re: Черная дыра
(А.П. Васи,
28.07.2012 18:58, 1.9 КБайт)
ПродолжениеРассказФантастический сон о городе физиков.... - Re: Черная дыра
(В. А. Аксёнова,
28.07.2012 21:02, 256 Байт)
Черепащук говорил по телевидению,что чёрные дыры -это гипотетические объекты.... - Re: Черная дыра
(А.П. Васи,
28.07.2012 23:25, 6.0 КБайт)
Чтобы вы были в курсе... - Re: Черная дыра
(А.П. Васи,
29.07.2012 11:12, 1.2 КБайт)
\\\Но о пространстве речь не идёт.... - Re: Черная дыра
(В. А. Аксёнова,
29.07.2012 20:24, 890 Байт)
Кометы не притягиваются?... - Re: Черная дыра
(А.П. Васи,
29.07.2012 21:15, 1.7 КБайт)
Вы пожалуйста прочитайте... - Re: Черная дыра
(А.П. Васи,
29.07.2012 21:38, 4.9 КБайт)
В.А.АксёноваУважаемая прочтите... - Re: Черная дыра
(В. А. Аксёнова,
29.07.2012 23:18, 218 Байт)
Никто не жил миллиарды... - Re: Черная дыра
(А.П. Васи,
29.07.2012 23:58, 1.1 КБайт)
Вы очень доверчивая и легко... - Re: Черная дыра
(В. А. Аксёнова,
30.07.2012 12:16, 756 Байт)
Нет.Мне нельзя внушить... - Re: Черная дыра
(А.П. Васи,
3.08.2012 22:27, 871 Байт)
http://www.computerra.ru/own/wiebe/697220/\\\. Отсутствие системы популяризации... - Re: Черная дыра
(А.П. Васи,
4.08.2012 10:40, 369 Байт)
\\\А не верят официальной науке совсем?... - Re: Черная дыра
(А.П. Васи,
7.08.2012 1:13, 8.9 КБайт, ответов: 2)
Модератор опять забанил достаточно логичный форум.... - Re[2]: Черная дыра
(Е. А. Тихомиров,
10.08.2012 22:25, 4.2 КБайт)
Дружище А.П.Васи, спасибо... - Re[2]: Черная дыра
(Е. А. Тихомиров,
10.08.2012 23:37, 2.8 КБайт)
Дружище А.П.Васи, спасибо... - Re: Черная дыра
(А.П. Васи,
11.08.2012 0:21, 1003 Байт, ответов: 2)
Да уж Вы меня насмешили... - Re[2]: Черная дыра
(Е. А. Тихомиров,
13.08.2012 18:18, 2.8 КБайт, ответов: 1)
Вы не оригинальны, дружище... - Re[3]: Черная дыра
(Е. А. Тихомиров,
13.08.2012 20:06, 541 Байт)
Здесь опечатка. Следует читать: "... - Re: Черная дыра
(А.П. Васи,
11.08.2012 11:15, 1.9 КБайт)
\\\Чёрная дыра это пустотелый... - Re: Черная дыра
(А.П. Васи,
12.08.2012 11:04, 1.8 КБайт)
\\\Не секрет, что в настоящее... - Re: Черная дыра
(А.П. Васи,
12.08.2012 18:55, 2.0 КБайт)
\\\Действительно все теории не верны как ортовские, так и альтовские.... - Re: Черная дыра
(А.П. Васи,
13.08.2012 21:45, 32.5 КБайт)
Вы уважаемый не делайте поспешных... - Re: Черная дыра
(А.П. Васи,
13.08.2012 22:24, 656 Байт)
\\\Я лично писал Патону... - Re: Черная дыра
(А.П. Васи,
14.08.2012 6:57, 1.5 КБайт)
\\\Вы, дружище, говорите... - Re: Черная дыра
(А.П. Васи,
14.08.2012 7:05, 300 Байт, ответов: 1)
И звезда эфира - Звезда... - Re[2]: Черная дыра
(Е. А. Тихомиров,
14.08.2012 16:02, 638 Байт)
Дядя Саня, каким же методом... - Re: Черная дыра
(Е. А. Тихомиров,
14.08.2012 16:48, 1.8 КБайт)
Концепция массивного тела, гравитационное притяжение... - Re: Черная дыра
(А.П. Васи,
15.08.2012 6:48, 823 Байт, ответов: 1)
Вы меня удивляете я привел... - Re[2]: Черная дыра
(Е. А. Тихомиров,
15.08.2012 16:34, 1019 Байт)
Ну... - Re: Черная дыра
(А.П. Васи,
15.08.2012 22:28, 533 Байт, ответов: 1)
В реферируемый журнал... - Re[2]: Черная дыра
(Е. А. Тихомиров,
16.08.2012 16:44, 711 Байт)
С чего бы это Рыков стал бы мне помогать?... - Re: Черная дыра
(Е. А. Тихомиров,
21.08.2012 23:35, 1.9 КБайт)
По информации вышних, которую доводит... - Re: Черная дыра
(А.П. Васи,
24.08.2012 21:28, 1.1 КБайт)
Рассказ.Очень далёкая планета.... - Re: Черная дыра
(А.П. Васи,
24.08.2012 21:38, 636 Байт)
Е.А.ТихомировЯ... - Re: Черная дыра
(А.П. Васи,
24.08.2012 21:44, 707 Байт, ответов: 1)
Е.А.Тихомиров\\\От начала... - Re[2]: Черная дыра
(Е. А. Тихомиров,
24.08.2012 22:52, 989 Байт)
Дядя... - Re: Черная дыра
(А.П. Васи,
24.08.2012 23:30, 1.6 КБайт)
Я так понимаю что возраст... - Re: Черная дыра
(А.П. Васи,
24.08.2012 23:39, 1.1 КБайт)
\\\Чёрные дыры это объекты, которые... - Re: Черная дыра
(А.П. Васи,
25.08.2012 0:07, 692 Байт, ответов: 1)
Я не понимаю как можно заниматься переоткрытием черных дыр.... - Re[2]: Черная дыра
(Е. А. Тихомиров,
25.08.2012 12:12, 1.1 КБайт)
Дядя Васи, ну ты и чудак на букву "м".... - Re: Черная дыра
(А.П. Васи,
25.08.2012 12:36, 653 Байт, ответов: 1)
Вы хотите чтобы... - Re[2]: Черная дыра
(Е. А. Тихомиров,
26.08.2012 0:29, 2.5 КБайт)
Дядя Васи, дружище... - Re: Черная дыра
(А.П. Васи,
25.08.2012 20:29, 1.9 КБайт)
У меня в своё время... - Re: Черная дыра
(А.П. Васи,
25.08.2012 21:50, 8.8 КБайт)
Из моего разговора на поп мех.... - Re: Черная дыра
(А.П. Васи,
26.08.2012 1:29, 953 Байт, ответов: 1)
Мне до лампочки... - Re[2]: Черная дыра
(Е. А. Тихомиров,
26.08.2012 21:12, 3.7 КБайт)
Дружище, дядя Васи, ты не прав.... - Re: Черная дыра
(А.П. Васи,
26.08.2012 1:47, 507 Байт)
Если с психологической точки зрения... - Re: Черная дыра
(Е. А. Тихомиров,
29.08.2012 14:46, 1.4 КБайт)
В заключении разбора работы коллеги И. Д.... - Re: Черная дыра
(Е. А. Тихомиров,
29.08.2012 15:01, 637 Байт)
Вот что ещё забыл написать.... - Re: Черная дыра
(А.П. Васи,
12.09.2012 22:05, 1.4 КБайт, ответов: 2)
Ответ #191 : Сегодня... - Re[2]: Черная дыра
(С. В. Стоянов,
10.03.2013 13:49, 147 Байт, ответов: 1)
Да, и нас на планете... - Re[3]: Черная дыра
(О. А. Третьякова,
11.03.2013 16:56, 91 Байт)
А мне хочется побывать на Кубе или в Австрии - Re: Черная дыра
(А.П. Васи,
12.09.2012 23:57, 200 Байт, ответов: 1)
Я ещё два опыта... - Re[2]: Черная дыра
(Д. В. Третьяков,
19.09.2012 12:33, 177 Байт)
Спасибо за подробную информацию о Чёрных дырах.... - Re: Черная дыра
(А.П. Васи,
28.09.2012 21:40, 365 Байт)
Не понимаю почему... - Re: Черная дыра
(А.П. Васи,
28.09.2012 21:48, 575 Байт)
Естественно причину забанивания трём сторонникам... - Re: Черная дыра
(А.П. Васи,
28.09.2012 21:55, 504 Байт)
---я мыслю закинул... - Re: Черная дыра
(А.П. Васи,
29.09.2012 17:09, 1.6 КБайт)
Re: Мировая эфиродинамическая гонка объявлена... - Re: Черная дыра
(А.П. Васи,
28.10.2012 18:11, 1.6 КБайт)
Ответ #1182 : Сегодня... - Re: Черная дыра
(А.П. Васи,
28.10.2012 18:16, 344 Байт)
\\\длина одного того же стержня... - Re: Черная дыра
(А.П. Васи,
28.10.2012 20:55, 1.0 КБайт)
- Re: Черная дыра
(А.П. Васи,
29.10.2012 0:42, 1.1 КБайт)
Давно читал книжку про мозговой штурм.... - Re: Черная дыра
(А.П. Васи,
4.11.2012 13:56, 2.7 КБайт)
Вопросы по теории относительности... - Re: Черная дыра
(А.П. Васи,
16.11.2012 0:45, 5.7 КБайт)
------------Бывает приятно вспомнить какая была интеллектуальная борьба на мембране.... - Re: Черная дыра
(А.П. Васи,
16.11.2012 0:48, 2.6 КБайт)
КаримХайдаров - Re: Черная дыра
(А.П. Васи,
6.01.2013 13:08, 764 Байт)
http://www.sciteclibrary.ru/cgi-bin/yabb2/YaBB.pl?num=1354298449/140Барышня своей хорошей... - Re: Черная дыра
(А.П. Васи,
7.01.2013 20:10, 1.3 КБайт)
http://www.sciteclibrary.ru/cgi-bin/yabb2/YaBB.pl?num=1350558609/2547#2547 Re: Эфир для чайников.... - Re: Черная дыра
(А. С. Иванов,
8.01.2013 3:05, 471 Байт, ответов: 1)
А знаете... - Re[2]: Черная дыра
(Ю. С. Решников,
8.01.2013 10:55, 409 Байт)
Очередной перенос лабораторных процессов в астрономическое поле.... - Re: Черная дыра
(А.П. Васи,
8.01.2013 10:37, 38.2 КБайт)
-----------------------------------http://www.popmech.ru/article/10479-dyira-kak-vyiklyuchatel/page/4/\\\Скорость рождения новых... - Re: Черная дыра
(А.П. Васи,
8.01.2013 10:42, 622 Байт)
\\\А знаете... - Re: Черная дыра
(А.П. Васи,
8.01.2013 23:00, 1.4 КБайт, ответов: 1)
Мне крайне неприятно когда кто-то... - Re[2]: Черная дыра
(Ю. С. Решников,
9.01.2013 8:22, 568 Байт)
Зачем повторять известные определения? Определим по теме.... - Re: Черная дыра
(А.П. Васи,
9.01.2013 0:02, 275 Байт)
http://www.sciteclibrary.ru/cgi-bin/yabb2/YaBB.pl?num=1357553088/180Эта красивая придворная... - Re: Черная дыра
(А.П. Васи,
9.01.2013 0:03, 65 Байт)
Эта собачка будет загрызать каждого пса долго и медленно. - Re: Черная дыра
(А.П. Васи,
9.01.2013 11:01, 298 Байт)
А это уважаемый... - Re: Черная дыра
(А.П. Васи,
9.01.2013 11:06, 265 Байт, ответов: 5)
А если я сказал... - Re[2]: Черная дыра
(Ю. С. Решников,
9.01.2013 12:18, 575 Байт, ответов: 4)
Давайте разберём ещё одну область... - Re[3]: Черная дыра
(Ю. С. Решников,
9.01.2013 13:44, 557 Байт, ответов: 3)
Астрономию и химию роднит... - Re[4]: Черная дыра
(Ю. С. Решников,
9.01.2013 22:34, 451 Байт, ответов: 2)
Космос - плазма, гравитация, поля, химия, излучение, составляющие астрономические комплексы (объекты).... - Re[5]: Черная дыра
(Ю. С. Решников,
10.01.2013 11:19, 536 Байт, ответов: 1)
Что, важно - физика имеет в астрономии только (!) излучения.... - Re[6]: Черная дыра
(Ю. С. Решников,
11.01.2013 7:23, 555 Байт)
В астрокомплексе (объекте) выделяются группы... - Re: Черная дыра
(А.П. Васи,
11.01.2013 9:57, 2.4 КБайт, ответов: 3)
Как говорится ничего личного.... - Re[2]: Черная дыра
(Ю. С. Решников,
11.01.2013 13:48, 567 Байт, ответов: 2)
Васи признайтесь себе, что астрономия вам не нужна.... - Re[3]: Черная дыра
(Ю. С. Решников,
11.01.2013 15:18, 543 Байт, ответов: 1)
Физическое пространство существует.... - Re[4]: Черная дыра
(Ю. С. Решников,
11.01.2013 15:36, 439 Байт)
С имеющей место быть, абсолютной... - Re: Черная дыра
(А.П. Васи,
11.01.2013 22:30, 1.6 КБайт)
Вы здесь не пишите... - Re: Черная дыра
(А.П. Васи,
12.01.2013 0:01, 2.3 КБайт)
Если у кого есть возможность... - Re: Черная дыра
(А.П. Васи,
12.01.2013 0:11, 758 Байт)
Мне естественно не понятно почему... - Re: Черная дыра
(А.П. Васи,
12.01.2013 0:21, 4.2 КБайт)
- Re: Черная дыра
(А.П. Васи,
12.01.2013 10:32, 1.0 КБайт, ответов: 1)
Большой взрыв - термодинамика.Абсурдность большого... - Re[2]: Черная дыра
(Ю. С. Решников,
12.01.2013 10:59, 534 Байт)
Большой взрыв точно присутствует... - Re: Черная дыра
(А.П. Васи,
12.01.2013 11:47, 1.7 КБайт)
Ю.С.Решников---------------------------Вы здесь... - Re: Черная дыра
(А.П. Васи,
12.01.2013 11:54, 441 Байт, ответов: 1)
Ю.С.Решников... - Re[2]: Черная дыра
(Ю. С. Решников,
12.01.2013 13:19, 580 Байт)
Физический абсолютизм в действии: в теориях и отношениях.... - Re: Черная дыра
(А.П. Васи,
12.01.2013 16:00, 466 Байт, ответов: 2)
Ю.С.Решников... - Re[2]: Черная дыра
(Ю. С. Решников,
12.01.2013 18:18, 508 Байт, ответов: 1)
По Вашему... - Re[3]: Черная дыра
(Ю. С. Решников,
12.01.2013 18:54, 455 Байт)
Правильный ответ - тема раскрывается астрофизически.... - Re: Черная дыра
(А.П. Васи,
12.01.2013 18:20, 499 Байт)
Ю.С.Решников... - Re: Черная дыра
(А.П. Васи,
12.01.2013 19:03, 532 Байт)
Ю.С.Решников... - Re: Черная дыра
(Ю. С. Решников,
18.01.2013 18:14, 463 Байт, ответов: 2)
Планетная химия возникает из астрохимии. Астрохимия происходит из астроПротохимии.... - Re[2]: Черная дыра
(Ю. С. Решников,
19.01.2013 1:14, 557 Байт, ответов: 1)
Скорость быстрее света должна... - Re[3]: Черная дыра
(Ю. С. Решников,
19.01.2013 9:58, 349 Байт)
ПВК необходима скорость достаточная... - Re: Черная дыра
(В. Б. Данеев,
19.01.2013 17:11, 577 Байт, ответов: 2)
Священна река Эридан. С Крещением.... - Re[2]: Черная дыра
(Ю. С. Решников,
20.01.2013 9:23, 575 Байт)
Да, поэзия красивая конечно. Продолжением... - Re[2]: Черная дыра
(В. П.,
24.01.2013 22:10, 1.3 КБайт)
- Re: Черная дыра
(В. П.,
24.01.2013 22:02, 349 Байт)
Скажите, а я правильно понимаю... - Re: Черная дыра
(Ю. С. Решников,
26.01.2013 10:48, 564 Байт)
В астрономии все пасутся, включая физиков и теологов.... - Re: Черная дыра
(С. А. Пикалёв,
2.02.2013 16:20, 248 Байт)
Почему, электрон или протон... - Re: Черная дыра
(А.П. Васи,
2.02.2013 21:58, 255 Байт)
Рекомендую использовать исключительно авторское определение о Черных Дырах.... - Re: Черная дыра
(С. А. Пикалёв,
3.02.2013 0:46, 165 Байт, ответов: 1)
Можно сформулировать иначе. Почему, Вселенная... - Re[2]: Черная дыра
(А.П. Васи,
3.02.2013 11:32, 361 Байт)
И если Вы задаёте Вопрос... - Re: Черная дыра
(А.П. Васи,
3.02.2013 11:19, 419 Байт)
Когда придумывайте всякое лайно... - Re: Черная дыра
(А.П. Васи,
3.02.2013 11:21, 122 Байт)
И прочтите сперва эту ветку... - Re: Черная дыра
(С. А. Пикалёв,
3.02.2013 15:08, 268 Байт)
Пробежался по ветке. Пришёл... - Re: Черная дыра
(А.П. Васи,
3.02.2013 15:43, 33.4 КБайт)
Если бы читали внимательно... - Re: Черная дыра
(в. г. грузинов,
5.02.2013 20:57, 225 Байт)
Может черная дыра быть наподобие... - Re: Черная дыра
(А.П. Васи,
5.02.2013 22:33, 235 Байт, ответов: 2)
\\\мы видим как она поглощает\\\Кто и когда это видел.... - Re[2]: Черная дыра
(В. А. Бурдин,
9.02.2013 14:57, 824 Байт, ответов: 1)
К сожалению не прочитал... - Re[3]: Черная дыра
(В. А. Бурдин,
9.02.2013 15:02, 340 Байт)
Отвечая на вопрос ''мы видим... - Re: Черная дыра
(А.П. Васи,
9.02.2013 17:08, 284 Байт)
Я над вопросом думаю долго... - Re: Черная дыра
(А.П. Васи,
14.02.2013 23:58, 866 Байт)
\\\Простая задача для электриков.\\\Старость... - Re: Черная дыра
(А.П. Васи,
16.02.2013 2:33, 3.0 КБайт)
Простая задача для электриков.---------------------------- Простая задача для электриков.... - Re: Черная дыра
(А.П. Васи,
16.02.2013 19:41, 2.3 КБайт)
--------------------------------------------------------Так и охота сказать... - Re: Черная дыра
(А.П. Васи,
16.02.2013 19:46, 113 Байт)
Трансформатор не делает сдвига фаз на сто двадцать градусов.... - Re: Черная дыра
(А.П. Васи,
17.02.2013 13:17, 1.1 КБайт)
А вот и награда нашла своего героя.... - Re: Черная дыра
(А.П. Васи,
17.02.2013 13:18, 266 Байт, ответов: 1)
Немного адекватного. Насколько можно доверять выводам астрофизиков? 15.01.2013 - Re[2]: Черная дыра
(в. г. грузинов,
20.02.2013 16:49, 859 Байт)
Наш глаз это тоже черная дыра или ,нора?.... - Re: Черная дыра
(А.П. Васи,
24.02.2013 14:16, 1.7 КБайт)
Re: Вихревой объект. Материализация Вселенной.... - Re: Черная дыра
(А.П. Васи,
26.02.2013 0:07, 5.0 КБайт)
- Re: Черная дыра
(А.П. Васи,
26.02.2013 0:13, 118 Байт)
И... - Re: Черная дыра
(А.П. Васи,
26.02.2013 1:31, 1.8 КБайт)
Ох я и насмеялся... - Re: Черная дыра
(А.П. Васи,
26.02.2013 1:33, 242 Байт)
http://www.popmech.ru/images/upload/..._23_1356623136_resize.jpg - Re: Черная дыра
(А.П. Васи,
26.02.2013 1:34, 134 Байт)
http://www.popmech.ru/blogs/post/5087-osobennosti-formirovaniya-struynyih-vyibrosov-aktivnyih-galakticheskih-yader-i-chernyih-dyir-ch/ - Re: Черная дыра
(А.П. Васи,
26.02.2013 2:02, 1.0 КБайт)
- Re: Черная дыра
(А.П. Васи,
2.03.2013 21:11, 4.0 КБайт)
\\\Это так называемые признаки prima... - Re: Черная дыра
(А.П. Васи,
2.03.2013 21:34, 398 Байт)
По большому счёту - борьбой с лженаукой можно и не страдать.... - Re: Черная дыра
(А.П. Васи,
3.03.2013 15:41, 4.6 КБайт)
Материал из Википедии свободной энциклопедии... - Re: Черная дыра
(А.П. Васи,
17.03.2013 15:00, 1.4 КБайт)
Читал про разные опыты по измерениям.... - Re: Черная дыра
(А.П. Васи,
21.03.2013 13:45, 3.0 КБайт)
Я вот не понимаю... - Re: Черная дыра
(А.П. Васи,
21.03.2013 23:08, 9.3 КБайт)
Удивило название форума.Это автор совсем не далёкий.... - Re: Черная дыра
(А.П. Васи,
21.03.2013 23:13, 100 Байт)
Самое смешное что физически... - Re: Черная дыра
(А.П. Васи,
22.03.2013 4:36, 2.0 КБайт)
По большому счёту развели детский... - Re: Черная дыра
(А.П. Васи,
22.03.2013 4:38, 1.8 КБайт)
Предыдущее это моё мнение по этому тексту - Re: Черная дыра
(А.П. Васи,
22.03.2013 4:53, 777 Байт)
Вот из ссылки которую... - Re: Черная дыра
(А.П. Васи,
22.03.2013 13:48, 422 Байт)
Я думаю что здесь большинство... - Re: Черная дыра
(А.П. Васи,
22.03.2013 21:23, 3.3 КБайт)
Почитал опять такое смешное что вынужден рассказать своими словами.... - Re: Черная дыра
(А.П. Васи,
22.03.2013 21:38, 806 Байт)
Дело в следующем, подобный... - Re: Черная дыра
(А.П. Васи,
22.03.2013 21:55, 506 Байт)
В примитиве - подобный опыт можно... - Re: Черная дыра
(А.П. Васи,
23.03.2013 1:22, 4.7 КБайт)
С моей точки зрения... - Re: Черная дыра
(А.П. Васи,
23.03.2013 2:06, 5.3 КБайт)
А слёта с интеллектуальных катушек... - Re: Черная дыра
(А.П. Васи,
25.03.2013 14:08, 7.2 КБайт)
Прочитал текст от чмырдяя который... - Re: Черная дыра
(А.П. Васи,
25.03.2013 19:34, 1.5 КБайт)
То что адекватности... - Re: Черная дыра
(А.П. Васи,
25.03.2013 22:29, 2.4 КБайт)
Сообщений: 5062 Re: Почему нет светового трансформатора?... - Re: Черная дыра
(А.П. Васи,
26.03.2013 10:20, 2.0 КБайт)
Вот и ещё один релятивист... - Re: Черная дыра
(о. с. баранов,
28.03.2013 21:30, 341 Байт)
хотелось бы сделать одно уточнение.... - Re: Черная дыра
(А.П. Васи,
28.03.2013 22:40, 740 Байт)
Ваше мнение о черных дырах... - Re: Черная дыра
(А.П. Васи,
28.03.2013 22:46, 370 Байт)
Меня естественно удивляет интеллектуальность... - Re: Черная дыра
(А.П. Васи,
28.03.2013 22:50, 183 Байт, ответов: 1)
И не забывайте самое главное... - Re[2]: Черная дыра
(о. с. баранов,
29.03.2013 0:43, 17 Байт)
много слов - Re: Черная дыра
(А.П. Васи,
29.03.2013 0:53, 35 Байт)
Моё общение с Вами закрыто. - Re: Черная дыра
(о. с. баранов,
29.03.2013 13:15, 8 Байт)
z - Re: Черная дыра
(А.П. Васи,
31.03.2013 19:41, 14.3 КБайт)
Такое прочитал, я аж заулыбался... - Re: Черная дыра
(А.П. Васи,
31.03.2013 19:52, 47.9 КБайт)
И мой вариант---------------------=============================================---------------------------------------------------------Внимательно рассматривал... - Re: Черная дыра
(А.П. Васи,
31.03.2013 19:54, 4.8 КБайт)
Мой вариант, продолжение---------------------------------------Галактика с расслоением.... - Re: Черная дыра
(А.П. Васи,
3.04.2013 22:59, 1.6 КБайт)
Рассмешил меня этот специалист по опытам Томаса Юнга.... - Re: Черная дыра
(А.П. Васи,
3.04.2013 23:03, 211 Байт)
Опыты Томаса Юнга в среднем... - Re: Черная дыра
(А.П. Васи,
6.04.2013 12:19, 2.6 КБайт)
Re: Знаем ли мы физику?... - Re: Черная дыра
(А.П. Васи,
6.04.2013 13:17, 9.5 КБайт)
В пространство между двумя пластинами... - Re: Черная дыра
(А.П. Васи,
6.04.2013 13:33, 1.3 КБайт)
Для тех кто не понял... - Re: Черная дыра
(А.П. Васи,
6.04.2013 14:29, 400 Байт)
Надеюсь что догадались... - Re: Черная дыра
(А.П. Васи,
8.04.2013 22:23, 5.2 КБайт)
Обозреватель Сообщений: 7 816Рейтинг: +223/-57"..... - Re: Черная дыра
(А.П. Васи,
9.05.2013 22:46, 4.1 КБайт)
Высшее образование - "Астроном"... - Re: Черная дыра
(А.П. Васи,
9.05.2013 23:16, 234 Байт)
Естественно что должно быть место... - Re: Черная дыра
(А.П. Васи,
10.05.2013 12:36, 6.0 КБайт)
Ответ... - Re: Черная дыра
(А.П. Васи,
11.05.2013 14:04, 3.2 КБайт)
Прочитал две темы, аж улыбнулся... - Re: Черная дыра
(А.П. Васи,
11.05.2013 14:13, 627 Байт)
Собственно как определить не специалиста... - Re: Черная дыра
(А.П. Васи,
13.05.2013 22:53, 4.8 КБайт)
Яркий пример когда задача превышает... - Re: Черная дыра
(А.П. Васи,
13.05.2013 23:44, 1.0 КБайт)
Я подскажу в чём ошибка у всех.... - Re: Черная дыра
(А.П. Васи,
13.05.2013 23:47, 177 Байт)
По простому надо быть логичным... - Re: Черная дыра
(А.П. Васи,
14.05.2013 9:20, 839 Байт)
Глобальная ошибка - практически никто... - Re: Черная дыра
(А.П. Васи,
16.05.2013 9:56, 822 Байт, ответов: 1)
Ответ #525 : Вчера... - Re[2]: Черная дыра
(А. В. Малкин,
16.05.2013 15:48, 108 Байт)
По-моему, мы уже не в тему пишем. - Re: Черная дыра
(А.П. Васи,
16.05.2013 23:36, 333 Байт)
Есть поговорка старого пса новым... - Re: Черная дыра
(А.П. Васи,
17.05.2013 20:28, 1.4 КБайт)
Ответ... - Re: Черная дыра
(А.П. Васи,
22.05.2013 0:10, 1.9 КБайт)
Ответ #306 : Сегодня в 19:34:53 Президент РАН Ю.... - Re: Черная дыра
(А.П. Васи,
23.05.2013 23:35, 3.6 КБайт)
Ответ #460 : Сегодня... - Re: Черная дыра
(А.П. Васи,
24.05.2013 8:55, 2.5 КБайт)
Модератор Сообщений: 11 530Рейтинг: +115/-16Мне нравится этот форум!... - Re: Черная дыра
(А.П. Васи,
24.05.2013 9:15, 388 Байт)
Правильно бы было при отмене... - Re: Черная дыра
(А.П. Васи,
27.05.2013 22:09, 923 Байт)
: 17.04.2005 [18:32:29] Интерференция... - Re: Черная дыра
(А.П. Васи,
28.05.2013 21:30, 1.9 КБайт)
Ответ #842 : Вчера... - Re: Черная дыра
(А.П. Васи,
28.05.2013 22:05, 207 Байт)
Можно и другие названия Примитивная... - Re: Черная дыра
(А.П. Васи,
30.05.2013 9:55, 1.7 КБайт)
Собственно направление правильное - но результат... - Re: Черная дыра
(А.П. Васи,
30.05.2013 9:56, 322 Байт)
Предыдущий текст по этому форуму.... - Re: Черная дыра
(А.П. Васи,
9.06.2013 13:19, 2.4 КБайт)
AstroBlogs.ru|Вчера... - Re: Черная дыра
(А.П. Васи,
14.06.2013 9:30, 1.3 КБайт)
Космологический "рифт", "... - Re: Черная дыра
(А.П. Васи,
14.06.2013 9:38, 428 Байт)
В принципе... - Re: Черная дыра
(А.П. Васи,
14.06.2013 21:38, 2.9 КБайт)
Немного расскажу понятно. Собственно... - Re: Черная дыра
(А.П. Васи,
18.06.2013 22:18, 74 Байт)
http://www.popmech.ru/article/13312-relyativistskaya-pena/page/2/#comments - Re: Черная дыра
(А.П. Васи,
18.06.2013 22:21, 51.1 КБайт)
- Re: Черная дыра
(А.П. Васи,
18.06.2013 22:23, 78.8 КБайт)
- Re: Черная дыра
(А.П. Васи,
18.06.2013 22:24, 30 Байт)
Просто понравилось обсуждение. - Re: Черная дыра
(А.П. Васи,
18.06.2013 22:52, 248 Байт)
Для тех кто не знает... - Re: Черная дыра
(А.П. Васи,
18.06.2013 23:07, 1.3 КБайт)
Уважаемый Дмитрий Мамонтов, прошу... - Re: Черная дыра
(А.П. Васи,
19.06.2013 7:23, 31.1 КБайт)
- Re: Черная дыра
(А.П. Васи,
19.06.2013 7:27, 446 Байт)
\\\Термин "жидкость"... - Re: Черная дыра
(А.П. Васи,
19.06.2013 8:06, 3.9 КБайт)
Чтобы были в курсе... - Re: Черная дыра
(А.П. Васи,
19.06.2013 8:32, 17.6 КБайт)
Модератор хочет удалить... - Re: Черная дыра
(А.П. Васи,
19.06.2013 8:55, 14.8 КБайт)
Собственно обосновать неправильность большого взрыва... - Re: Черная дыра
(А.П. Васи,
19.06.2013 8:56, 1.2 КБайт)
\\\Канадский астрофизик Э. Мак-Келлар... - Re: Черная дыра
(А.П. Васи,
19.06.2013 10:07, 20.9 КБайт)
Сегодня день непонятный, на солнце видно выброс глупости.... - Re: Черная дыра
(А.П. Васи,
20.06.2013 23:53, 789 Байт)
Я так понимаю что прочитав... - Re: Черная дыра
(V. E. Krauchuk,
21.06.2013 23:21, 508 Байт)
1 Рыкову. Не заставляйте... - Re: Черная дыра
(V. E. Krauchuk,
21.06.2013 23:39, 552 Байт)
А П. Васи! Спасибо за подвиженсво!Честно!... - Re: Черная дыра
(А.П. Васи,
22.06.2013 0:55, 2.3 КБайт)
- Re: Черная дыра
(А.П. Васи,
22.06.2013 0:57, 4.9 КБайт)
- Re: Черная дыра
(А.П. Васи,
22.06.2013 1:06, 9.9 КБайт)
- Re: Черная дыра
(А.П. Васи,
22.06.2013 21:59, 9.1 КБайт)
Новичок Сообщений: 2Рейтинг: +1/-0Мне нравится этот форум!... - Re: Черная дыра
(А.П. Васи,
22.06.2013 23:25, 5.9 КБайт)
Модератор Сообщений: 13 213Рейтинг: +350/-46Эвона как...... - Re: Черная дыра
(А.П. Васи,
23.06.2013 14:46, 3.4 КБайт, ответов: 1)
Ответ #106 : Сегодня... - Re[2]: Черная дыра
(А. В. Малкин,
23.06.2013 22:37, 3.7 КБайт)
Может быть... правильная мысль! - Re: Черная дыра
(А.П. Васи,
24.06.2013 0:37, 988 Байт)
Не не может... - Re: Черная дыра
(А.П. Васи,
24.06.2013 0:48, 695 Байт)
Так... - Re: Черная дыра
(А.П. Васи,
28.06.2013 14:50, 3.6 КБайт)
Сомневаюсь что науку будут делать не званиями а способностями.... - Re: Черная дыра
(А.П. Васи,
3.07.2013 9:00, 4.9 КБайт)
У альтернативщиков и сторонников эфира своё мнение.... - Re: Черная дыра
(А.П. Васи,
3.07.2013 9:12, 3.2 КБайт)
- Re: Черная дыра
(А.П. Васи,
3.07.2013 22:25, 5.1 КБайт)
О-хо-хо прочитал нечто такое... - Re: Черная дыра
(А. В. Коновалов,
8.07.2013 1:25, 1.6 КБайт)
Это тяжело объяснить, как Нечто... - Re: Черная дыра
(А.П. Васи,
8.07.2013 9:41, 297 Байт)
Данная тема не предназначена для бреда который кому-то кажется.... - Re: Черная дыра
(А.П. Васи,
8.07.2013 9:53, 1.6 КБайт)
\\\Чёрная дыра это то единственное... - Re: Черная дыра
(А.П. Васи,
8.07.2013 9:53, 1.6 КБайт)
\\\Чёрная дыра это то единственное... - Re: Черная дыра
(А.П. Васи,
11.07.2013 22:39, 1.4 КБайт)
С моей точки зрения... - Re: Черная дыра
(А.П. Васи,
11.07.2013 22:40, 223 Байт)
Как по мне очень малое... - Re: Черная дыра
(В. Р. Скенс,
12.07.2013 11:49, 200 Байт)
Из "Черной Дыры" как известно... - Re: Черная дыра
(А.П. Васи,
13.07.2013 18:28, 247 Байт)
\\\Из "Черной Дыры"... - Re: Черная дыра
(А.П. Васи,
13.07.2013 18:41, 1.6 КБайт)
: Вчера... - Re: Черная дыра
(А.П. Васи,
13.07.2013 19:07, 486 Байт)
Дмитрий Вибе на сколько... - Re: Черная дыра
(А.П. Васи,
13.07.2013 19:10, 1.0 КБайт)
http://www.astrogorizont.com/user_files/Image/content/img1942_pg1208_small.jpg - Re: Черная дыра
(А.П. Васи,
13.07.2013 19:26, 871 Байт)
Каменный век , другое мнение другой... - Re: Черная дыра
(А.П. Васи,
13.07.2013 20:05, 26.0 КБайт)
Vallav Ветеран форума Вне ФорумаСообщений... - Re: Черная дыра
(А.П. Васи,
13.07.2013 20:08, 1.7 КБайт)
То́мас Юнг -Википедия... - Re: Черная дыра
(В. Р. Скенс,
17.07.2013 6:47, 282 Байт)
Прочитал первые 12 страниц бреда... - Re: Черная дыра
(А.П. Васи,
21.07.2013 11:50, 1.2 КБайт)
О Науке, космосе и бытие... - Re: Черная дыра
(А.П. Васи,
22.07.2013 8:28, 1.1 КБайт)
\\\Прочитал первые 12 страниц бреда... - Re: Черная дыра
(С. М. Андрейчук,
4.08.2013 11:42, 1.1 КБайт)
Фотон ограничен в своей скорости 300.000 км/с проницаемостью пространства.... - Re: Черная дыра
(А.П. Васи,
4.08.2013 16:49, 54 Байт, ответов: 1)
Шел бы ты старче от сюда со своим старческим маразмом. - Re[2]: Черная дыра
(С. М. Андрейчук,
6.08.2013 16:26, 991 Байт)
Уважаемый А.П. Васи, осуждение... - Re: Черная дыра
(А.П. Васи,
6.08.2013 21:56, 2.5 КБайт, ответов: 2)
Возможно я по отношению... - Re[2]: Черная дыра
(С. М. Андрейчук,
7.08.2013 12:41, 1.3 КБайт, ответов: 1)
Исходя из вашего вывода возникает... - Re[3]: Черная дыра
(С. М. Андрейчук,
7.08.2013 20:30, 434 Байт)
Думаю, что только определённая частота... - Re: Черная дыра
(А.П. Васи,
7.08.2013 20:59, 1.0 КБайт)
Всё что Вы можете придумать я уже давно написал ответы.... - Re: Черная дыра
(А.П. Васи,
7.08.2013 21:28, 5.4 КБайт)
Поймите правильно я начинал обсуждать... - Re: Черная дыра
(О. Е. Коробейникова,
7.08.2013 22:25, 142 Байт)
www.liveinternet.ru/users5276115/post/286324507/ Живем в "черной дыре.... - Re: Черная дыра
(О. Е. Коробейникова,
7.08.2013 22:42, 108 Байт)
Живем в "плену..... - Re: Черная дыра
(А.П. Васи,
7.08.2013 22:44, 1.1 КБайт)
Я надеюсь Вы понимаете... - Re: Черная дыра
(А.П. Васи,
7.08.2013 23:54, 4.4 КБайт)
- Re: Черная дыра
(А.П. Васи,
8.08.2013 0:05, 772 Байт, ответов: 2)
\\\Фотон ограничен в своей скорости 300.000 км/с проницаемостью пространства.... - Re[2]: Черная дыра
(С. М. Андрейчук,
8.08.2013 19:58, 441 Байт, ответов: 1)
Вы меня процитировали и назвали релятивистом.... - Re[3]: Черная дыра
(С. М. Андрейчук,
14.08.2013 15:44, 3.4 КБайт)
Это всего лишь моя гипотеза... - Re: Черная дыра
(А.П. Васи,
14.08.2013 22:03, 814 Байт)
Вы не правильно трактуете звезду... - Re: Черная дыра
(А.П. Васи,
14.08.2013 22:05, 79 Байт, ответов: 1)
Если честно то у Вас глупость несусветная бессмысленная и бесполезная. - Re[2]: Черная дыра
(С. М. Андрейчук,
14.08.2013 22:54, 820 Байт)
Глупость - это не логичность и не соответствие здравому смыслу.... - Re: Черная дыра
(А.П. Васи,
14.08.2013 23:36, 1.1 КБайт)
Мне до лампочки то что Вы пишите.... - Re: Черная дыра
(А.П. Васи,
15.08.2013 0:04, 979 Байт)
\\\Но если Вы принципиально против... - Re: Черная дыра
(А.П. Васи,
15.08.2013 0:22, 426 Байт, ответов: 1)
- Re[2]: Черная дыра
(С. М. Андрейчук,
15.08.2013 9:06, 627 Байт)
Хочу сказать... - Re: Черная дыра
(А.П. Васи,
18.08.2013 15:33, 2.0 КБайт)
\\\ : 16.08.2013 [15:04:07] Весьма... - Re: Черная дыра
(А.П. Васи,
18.08.2013 23:14, 940 Байт)
Колонка Дмитрий Вибе Может быть, астрономия в школе всё-таки нужна?... - Re: Черная дыра
(А. А. Волков,
19.08.2013 13:12, 1.6 КБайт)
Уважаемый А.П.... - Re: Черная дыра
(А.П. Васи,
21.08.2013 21:40, 1.4 КБайт)
Да уж я такое... - Re: Черная дыра
(А.П. Васи,
24.08.2013 14:55, 887 Байт)
Re: Чёрные дыры - дыры в пространстве или в науке?... - Re: Черная дыра
(А.П. Васи,
24.08.2013 15:49, 1.1 КБайт)
Как-то давно видел в ванной... - Re: Черная дыра
(А.П. Васи,
25.08.2013 13:44, 1.5 КБайт)
Re: Новый взгляд на физику частиц.... - Re: Черная дыра
(А.П. Васи,
25.08.2013 23:31, 2.2 КБайт)
http://www.veinik.ru/science/anomal/article/919.html\\\ "Реликтовое излучение... - Re: Черная дыра
(А.П. Васи,
25.08.2013 23:33, 2.1 КБайт)
http://www.veinik.ru/science/anomal/article/919.html\\\ "Реликтовое излучение... - >> Re: Черная дыра
(А.П. Васи,
25.08.2013 23:56, 11.8 КБайт)
Если взять купюру и посмотреть... - Re: Черная дыра
(А.П. Васи,
27.08.2013 1:23, 1.1 КБайт)
Так вот - в 1941году открыто... - Re: Черная дыра
(А.П. Васи,
27.08.2013 1:37, 335 Байт)
Вот отсутствие такой мелочи... - Re: Черная дыра
(А.П. Васи,
5.09.2013 23:40, 2.7 КБайт)
Обозреватель Сообщений: 8 090Рейтинг: +267/-63"..... - Re: Черная дыра
(А.П. Васи,
5.09.2013 23:52, 4.4 КБайт)
Августина Завсегдатай форума На Форуме... - Re: Черная дыра
(А.П. Васи,
7.09.2013 17:46, 3.6 КБайт)
Ответ #141 : Сегодня... - Re: Черная дыра
(А.П. Васи,
7.09.2013 19:54, 1.6 КБайт)
Ответ #755 : Сегодня... - Re: Черная дыра
(А.П. Васи,
7.09.2013 20:05, 941 Байт)
Ни куя там нет релятивистских поправок.... - Re: Черная дыра
(А.П. Васи,
7.09.2013 20:12, 10.0 КБайт)
На сколько я помню... - Re: Черная дыра
(А.П. Васи,
7.09.2013 20:31, 452 Байт)
Для тех кто не понял... - Re: Черная дыра
(А.П. Васи,
10.09.2013 21:26, 1.8 КБайт)
---Мне аж смешно, как говорится... - Re: Черная дыра
(А.П. Васи,
11.09.2013 21:50, 2.3 КБайт)
\\\ Ответ #1 : Вчера... - Re: Черная дыра
(А.П. Васи,
11.09.2013 22:17, 2.5 КБайт)
Сообщений: 230Рейтинг... - Re: Черная дыра
(А.П. Васи,
13.09.2013 8:40, 2.2 КБайт, ответов: 1)
: Вчера... - Re[2]: Черная дыра
(А. С. Коломенский,
14.09.2013 20:27, 75 Байт)
Столько словесного поноса и умственного... - Re: Черная дыра
(А.П. Васи,
14.09.2013 21:32, 3.9 КБайт)
/// Re: Конец эфирной теории- finita la comédie.... - Re: Черная дыра
(А.П. Васи,
14.09.2013 21:36, 276 Байт)
А.С.Коломенский... - Re: Черная дыра
(А.П. Васи,
12.10.2013 12:03, 9.9 КБайт)
А текст то читается... - Re: Черная дыра
(А.П. Васи,
13.10.2013 21:11, 67.2 КБайт)
Это должен прочитать каждый,что-бы... - Re: Черная дыра
(А.П. Васи,
13.10.2013 21:19, 99.9 КБайт)
Перевод: Роман Чертанов, 29 мая 2013 г. - Re: Черная дыра
(А.П. Васи,
16.10.2013 23:48, 3.5 КБайт)
Прочитал так сказать стандартную ситуацию... - Re: Черная дыра
(А.П. Васи,
17.10.2013 0:48, 2.1 КБайт)
Ответ... - Re: Черная дыра
(А.П. Васи,
31.10.2013 23:15, 4.1 КБайт)
Вот не прошло и много... - Re: Черная дыра
(А.П. Васи,
31.10.2013 23:25, 632 Байт)
Меня смешит Вибе аки полный... - Re: Черная дыра
(А.П. Васи,
1.11.2013 0:10, 10.5 КБайт)
Вибе опозорился превзошел сам себя.... - Re: Черная дыра
(А.П. Васи,
6.11.2013 23:07, 1.5 КБайт)
Я естественно что-то логичное должен... - Re: Черная дыра
(А.П. Васи,
15.11.2013 23:39, 91 Байт)
http://www.astrogalaxy.ru/forum/phpBB2/viewtopic.php?f=2&t=4314Я думаю. - Re: Черная дыра
(А.П. Васи,
17.11.2013 10:50, 760 Байт)
У меня такое чувство... - Re: Черная дыра
(А.П. Васи,
17.11.2013 11:10, 5.0 КБайт)
Вот пример из жизни, некоторый... - Re: Черная дыра
(А.П. Васи,
17.11.2013 11:24, 1.6 КБайт)
Из википедии \\\ В случае распространения... - Re: Черная дыра
(А.П. Васи,
17.11.2013 15:07, 2.2 КБайт)
http://www.youtube.com/watch?v=hGm2gqs7dP8---------------------------------------------------------------- Изучаем формулы.------------------------------------------------Собственно... - Re: Черная дыра
(А.П. Васи,
17.11.2013 18:57, 764 Байт)
Что есть в наличии... - Re: Черная дыра
(А.П. Васи,
17.11.2013 20:08, 685 Байт)
Если разобраться детально с кинескопом... - Re: Черная дыра
(А.П. Васи,
18.11.2013 9:41, 2.6 КБайт)
С моей точки зрения... - Re: Черная дыра
(А.П. Васи,
20.11.2013 11:59, 2.1 КБайт)
Чтобы собственно провести... - Re: Черная дыра
(А.П. Васи,
20.11.2013 21:32, 479 Байт)
Как говорится даже не смешно... - Re: Черная дыра
(А.П. Васи,
22.11.2013 19:44, 4.3 КБайт)
Собственно борьба развивается очень мощная... - Re: Черная дыра
(А.П. Васи,
1.12.2013 0:00, 139 Байт)
Смотреть рекомендую только альтам, релятивистам скорей всего не понравиться.... - Re: Черная дыра
(А.П. Васи,
1.12.2013 1:43, 1.3 КБайт)
8 лекция. Гравитация. Ацюковский В.А.... - Re: Черная дыра
(А.П. Васи,
4.12.2013 3:11, 2.2 КБайт)
Сообщений: 15 011Рейтинг... - Re: Черная дыра
(А.П. Васи,
4.12.2013 3:29, 2.5 КБайт)
- Re: Черная дыра
(А.П. Васи,
4.12.2013 23:50, 3.2 КБайт)
Вот читаю и наблюдаю такое... - Re: Черная дыра
(А.П. Васи,
7.12.2013 14:43, 4.7 КБайт)
С одной стороны... - Re: Черная дыра
(А.П. Васи,
15.12.2013 7:59, 2.0 КБайт)
Мне и смешно и не смешно.... - Re: Черная дыра
(А.П. Васи,
22.12.2013 11:48, 2.8 КБайт)
Скажу Вам честно космологи - в данном случаи интеллектуальные малятка.... - Re: Черная дыра
(А.П. Васи,
22.12.2013 22:52, 4.8 КБайт, ответов: 1)
То что альты в основном... - Re[2]: Черная дыра
(Д. В. lom,
23.12.2013 12:56, 217 Байт)
Не врубаюсь. Не вижу коментов.... - Re: Черная дыра
(А.П. Васи,
23.12.2013 22:41, 2.6 КБайт)
Собственно и моя модель основана... - Re: Черная дыра
(А.П. Васи,
23.12.2013 22:49, 476 Байт)
\\\Такое ощущение, что чел (Васи) сам с собой разговаривает.... - Re: Черная дыра
(А.П. Васи,
26.12.2013 23:37, 1.5 КБайт)
Блин вот так и охота... - Re: Черная дыра
(А.П. Васи,
27.12.2013 0:05, 748 Байт)
С другой точки зрения есть поговорка, -"Юпитер - ты сердишься?... - Re: Черная дыра
(А.П. Васи,
27.12.2013 0:12, 578 Байт)
"Юпитер - ты сердишься?, - значит ты не прав.... - Re: Черная дыра
(А.П. Васи,
28.12.2013 14:42, 8.3 КБайт)
Уже даже барышня догадалась... - Re: Черная дыра
(А.П. Васи,
30.12.2013 9:41, 3.6 КБайт)
Да вот и ещё одного релятивиста - сразил старческий маразм.... - Re: Черная дыра
(А.П. Васи,
30.12.2013 14:13, 398 Байт)
По логике... - Re: Черная дыра
(А.П. Васи,
3.01.2014 15:11, 2.8 КБайт)
Я естественно... - Re: Черная дыра
(А.П. Васи,
3.01.2014 16:26, 721 Байт)
Уже прошли времена когда просили проектировщиков проектировать всё по уму.... - Re: Черная дыра
(А.П. Васи,
27.01.2014 23:00, 1.2 КБайт)
Красное смещение и искривление пространстваhttp... - Re: Черная дыра
(А.П. Васи,
1.02.2014 1:45, 2.5 КБайт)
- О, я смотрю уже взрослые задачи начинают одолевать.... - Re: Черная дыра
(А.П. Васи,
2.02.2014 14:09, 970 Байт)
За что Джону Шварцу иМайклу... - Re: Черная дыра
(А.П. Васи,
3.02.2014 23:27, 5.8 КБайт)
Сообщений: 920Рейтинг: +32/-2За забором кругозора - удивительное...... - Re: Черная дыра
(А.П. Васи,
18.02.2014 1:19, 2.7 КБайт)
Сообщений: 15 817Рейтинг... - Re: Черная дыра
(А.П. Васи,
27.02.2014 3:52, 2.7 КБайт)
Модератор Сообщений: 13 565Рейтинг: +169/-19Мне нравится этот форум!... - Re: Черная дыра
(А.П. Васи,
8.03.2014 11:50, 12.5 КБайт)
Сообщений: 2 104Рейтинг... - Re: Черная дыра
(А.П. Васи,
22.03.2014 12:52, 4.2 КБайт)
------------------------------------------ Модератор Сообщений: 14 513Рейтинг... - Re: Черная дыра
(А.П. Васи,
22.03.2014 19:17, 5.6 КБайт)
У Вибе естественно бывают проблески... - Re: Черная дыра
(А.П. Васи,
2.04.2014 20:28, 22.0 КБайт)
Сообщений: 366Рейтинг: +4/-0специалист... - Re: Черная дыра
(А.П. Васи,
2.04.2014 20:34, 240 Байт)
А с другой точки зрения... - Re: Черная дыра
(А.П. Васи,
2.04.2014 22:05, 3.0 КБайт)
Сообщений: 7 524Рейтинг... - Re: Черная дыра
(А.П. Васи,
14.04.2014 20:33, 117 Байт)
Там где звёзды редкие - звезды... - Re: Черная дыра
(А.П. Васи,
14.04.2014 21:16, 2.0 КБайт)
: 21.03.2014... - Re: Черная дыра
(А.П. Васи,
14.04.2014 22:16, 1.6 КБайт)
Для тех кто не понял... - Re: Черная дыра
(А.П. Васи,
14.04.2014 23:54, 1.8 КБайт)
Из серии чьябы корова бычала... - Re: Черная дыра
(А.П. Васи,
27.04.2014 19:46, 2.2 КБайт)
У меня такое чувство... - Re: Черная дыра
(А.П. Васи,
27.04.2014 19:49, 169 Байт)
Я думаю... - Re: Черная дыра
(А.П. Васи,
4.05.2014 16:48, 2.8 КБайт)
Читал для смеха-------------------------------------------------------------------- Ответ... - Re: Черная дыра
(А.П. Васи,
4.05.2014 17:16, 1.7 КБайт)
Что в итоге получилось - релятивисты послали альтов в пешее путешествие.... - Re: Черная дыра
(А.П. Васи,
4.05.2014 21:06, 2.5 КБайт)
Ответ... - Re: Черная дыра
(А.П. Васи,
4.05.2014 21:14, 310 Байт)
И самое смешное что релятивисты... - Re: Черная дыра
(А.П. Васи,
10.05.2014 17:39, 2.9 КБайт)
--------------------------------------------------------- Ответ #1058 : Сегодня... - Re: Черная дыра
(А.П. Васи,
11.05.2014 15:35, 8.9 КБайт)
--------------------------------------------------------------------- Re: Закон планетарных расстояний. Ответ... - Re: Черная дыра
(А.П. Васи,
11.05.2014 18:05, 3.6 КБайт)
Re: Закон планетарных расстояний. Ответ... - Re: Черная дыра
(А.П. Васи,
15.05.2014 23:03, 2.4 КБайт)
----------------------------------------------------------Re: Закон планетарных расстояний. Ответ... - Re: Черная дыра
(А.П. Васи,
18.05.2014 14:43, 1.4 КБайт)
-----------------------------------------------------------Re: Закон планетарных расстояний. Ответ... - Re: Черная дыра
(А.П. Васи,
21.05.2014 8:57, 1.4 КБайт)
---------------------------------------------------------------------------------------------------------Re: Про новые работы... - Re: Черная дыра
(А.П. Васи,
21.05.2014 9:23, 2.0 КБайт)
-----------------------------------------------------------------Re: Закон планетарных расстояний. Ответ... - Re: Черная дыра
(А.П. Васи,
21.05.2014 21:39, 10.8 КБайт)
-------------------------------------------------------------------------------------http://elementy.ru/trefil/21152 \\\Планеты движутся вокруг... - Re: Черная дыра
(А.П. Васи,
21.05.2014 21:45, 321 Байт)
Собственно... - Re: Черная дыра
(А.П. Васи,
23.05.2014 2:17, 3.6 КБайт)
--------------------------------------------------------------------------------------------------- Re: Существует ли облако Оорта? И в каком виде.... - Re: Черная дыра
(А.П. Васи,
23.05.2014 2:45, 4.3 КБайт)
-------------------------------------------------------------------------------------------- -------------------------------------------------------------------------------------------------------------Как раз открыл статью... - Re: Черная дыра
(А.П. Васи,
23.05.2014 12:07, 3.0 КБайт)
-------------------------------------------http://lenta.ru/news/2014/05/22/wormhole/\\\Физик из Кембриджа... - Re: Черная дыра
(А.П. Васи,
23.05.2014 15:45, 2.1 КБайт)
Астрономам не нравится что запретили... - Re: Черная дыра
(А.П. Васи,
23.05.2014 16:12, 2.3 КБайт)
----------------------------------------------------------------------------------------------------------------------------------Re: Закон планетарных расстояний. Ответ... - Re: Черная дыра
(А.П. Васи,
23.05.2014 16:16, 257 Байт)
И самое смешное... - Re: Черная дыра
(А.П. Васи,
23.05.2014 16:25, 5.0 КБайт)
----------------------------------------------------------------------------------------------------------------------------------Re: Закон планетарных расстояний. Ответ... - Re: Черная дыра
(А.П. Васи,
24.05.2014 15:10, 6.0 КБайт)
------------------------------------------------------------------------ В порядке бреда: Ракетный двигатель... - Re: Черная дыра
(А.П. Васи,
24.05.2014 17:45, 4.5 КБайт)
Безопорное движение... - Re: Черная дыра
(А.П. Васи,
24.05.2014 17:56, 889 Байт)
Собственно с моей точки зрения... - Re: Черная дыра
(А.П. Васи,
25.05.2014 13:34, 3.1 КБайт)
Сообщаем... - Re: Черная дыра
(А.П. Васи,
29.06.2014 14:07, 3.5 КБайт)
Физические котлеты и математические мухи. Вчера :: 18:10:57http://www.sciteclibrary.ru/cgi-bin/yabb2/YaBB.pl?... - Re: Черная дыра
(А.П. Васи,
1.07.2014 22:15, 2.1 КБайт)
--- \\\Почему на лекциях мало слушателей... - Re: Черная дыра
(А.П. Васи,
1.07.2014 22:43, 8.6 КБайт)
Re: Мировая эфиродинамическая гонка объявлена... - Теория пустоты vk.com/tviss
(Serg Ol,
5.07.2014 0:54, 25 Байт)
ответы на все вопросы - Re: Черная дыра
(А.П. Васи,
10.07.2014 12:56, 2.3 КБайт)
Re: О критиках и сторонниках... - Re: Черная дыра
(А.П. Васи,
10.07.2014 13:07, 11.3 КБайт)
Изначально надо определится с названиями, - сравнения и измерение.... - Re: Черная дыра
(А.П. Васи,
11.07.2014 11:51, 1.2 КБайт)
http://www.sciteclibrary.ru/cgi-bin/yabb2/YaBB.pl?num=1404154370/140#140 Re: О критиках... - Re: Черная дыра
(А.П. Васи,
11.07.2014 12:55, 1.9 КБайт)
http://www.sciteclibrary.ru/cgi-bin/yabb2/YaBB.pl?board=physik-alt http://www.sciteclibrary.ru/cgi-bin/yabb2/YaBB.pl?num=1404154370/142#142... - Re: Черная дыра
(А.П. Васи,
12.07.2014 9:54, 2.0 КБайт)
Re: О критиках и сторонниках... - Re: Черная дыра
(А.П. Васи,
12.07.2014 23:33, 3.3 КБайт)
--------------------------------------------------------------------------------------------------------------------------------------Ладно так как моски большинства... - Re: Черная дыра
(А.П. Васи,
13.07.2014 10:58, 4.7 КБайт)
- Re: Черная дыра
(А.П. Васи,
13.07.2014 13:33, 6.2 КБайт)
Время идёт а в космологии... - Re: Черная дыра
(в. н. беспалов,
22.07.2014 14:30, 1021 Байт)
Теория 2 Вся вселеная заполнена... - Re: Черная дыра
(А.П. Васи,
22.07.2014 16:09, 8.0 КБайт)
- Re: Черная дыра
(А.П. Васи,
22.07.2014 16:13, 13.5 КБайт)
- Re: Черная дыра
(А.П. Васи,
28.07.2014 10:26, 2.7 КБайт)
Инерция... - Re: Черная дыра
(А.П. Васи,
30.07.2014 0:32, 2.8 КБайт)
http://www.astrogorizont.com/content/read-Novyj_vzgljad - Re: Черная дыра
(А.П. Васи,
30.07.2014 0:52, 1.5 КБайт)
В предыдущем сообщении что собственно... - Re: Черная дыра
(А.П. Васи,
4.08.2014 16:15, 1.3 КБайт)
До последнего времени ученые-физики... - Re: Черная дыра
(А.П. Васи,
4.08.2014 17:00, 507 Байт)
Собственно здесь ситуация... - Re: Черная дыра
(А.П. Васи,
4.08.2014 17:14, 671 Байт)
http://peswiki.com/index.php/Directory:Emdrive_%28Electromagnetic_Space_Drive%29 SPR Prototype - Re: Черная дыра
(А.П. Васи,
4.08.2014 17:19, 193 Байт)
Посмотрел описание и чего-то... - Re: Черная дыра
(А.П. Васи,
4.08.2014 23:32, 1.1 КБайт)
http://www.dailytechinfo.org/news/6143-specialisty-nasa-zastavili-rabotat-nevozmozhnyy-dvigatel-kotoryy-v-buduschem-mozhet-navsegda-izmenit-oblast-kosmicheskoy-tehniki.html\\\Устройство двигателя Шауэра достаточно просто.... - Re: Черная дыра
(А.П. Васи,
5.08.2014 23:56, 1.1 КБайт)
http://www.astronews.ru/cgi-bin/mng.cgi?page=news&news=6334 \\\Ученые Стэнфорда... - Re: Черная дыра
(А.П. Васи,
6.08.2014 0:17, 1.9 КБайт)
Собственно ответ с точки зрения эфира - примитивней некуда.... - Re: Черная дыра
(А.П. Васи,
17.08.2014 11:16, 3.3 КБайт)
Модератор Сообщений: 14 999Рейтинг... - Re: Черная дыра
(А.П. Васи,
17.08.2014 17:08, 891 Байт)
Собственно у меня появилось логическое... - Re: Черная дыра
(А.П. Васи,
24.08.2014 14:25, 2.3 КБайт)
Вот Вибе рассуждает как временщик... - Re: Черная дыра
(А.П. Васи,
24.08.2014 21:07, 1.5 КБайт)
Даже не понимаю... - Re: Черная дыра
(А.П. Васи,
24.08.2014 22:28, 4.4 КБайт, ответов: 1)
Я вот смотрю... - Re[2]: Черная дыра
(А. В. Таликов,
5.09.2014 23:09, 323 Байт)
темп кварцевых и атомных часов... - Re: Черная дыра
(А.П. Васи,
25.08.2014 15:49, 1.6 КБайт)
Re: Эфирная Теория. Единая концепция.... - Re: Черная дыра
(А.П. Васи,
25.08.2014 16:07, 4.7 КБайт)
Я тоже написал самостоятельно - базовые... - Re: Черная дыра
(А.П. Васи,
25.08.2014 16:49, 3.0 КБайт)
http://www.astronews.ru/cgi-bin/mng.cgi?page=news&news=6454 \\\Разрушительные последствия мощного... - Re: Черная дыра
(А.П. Васи,
25.08.2014 16:56, 595 Байт)
Что собственно странно что никто... - Re: Черная дыра
(А.П. Васи,
6.09.2014 10:00, 295 Байт)
Вы не состоянии - сформулировать вопрос.... - Re: Черная дыра
(А.П. Васи,
13.09.2014 12:48, 2.2 КБайт)
Опыт Юнга. Эксперимент с двумя щелями.... - Re: Черная дыра
(А.П. Васи,
13.09.2014 12:51, 109 Байт)
Самое смешное что опыт можно... - Re: Черная дыра
(А.П. Васи,
23.09.2014 23:17, 3.0 КБайт)
26 августа 2014года. ТрВ 161, c.... - Re: Черная дыра
(А.П. Васи,
23.09.2014 23:19, 234 Байт)
"Здесь хоть ролик снимай... - Re: Черная дыра
(А.П. Васи,
24.09.2014 0:09, 329 Байт)
Легко релятивиста отличить от альта... - Re: Черная дыра
(А.П. Васи,
28.09.2014 14:03, 5.0 КБайт)
: 08.01.2003... - Re: Черная дыра
(А.П. Васи,
28.09.2014 14:13, 1.7 КБайт)
Собственно не могу понять почему... - Re: Черная дыра
(А.П. Васи,
28.09.2014 15:03, 1.8 КБайт)
\\\Что не публикует Астронет Astronet.ru... - Re: Черная дыра
(А.П. Васи,
8.10.2014 22:36, 4.4 КБайт, ответов: 1)
Ответ #31 : Сегодня... - Re[2]: Черная дыра
(Евгеньевна Львовянка,
27.10.2014 14:10, 64 Байт)
я не доверяю хоккингу www.tomas-morr.livejournal.com - Re: Черная дыра
(А.П. Васи,
14.10.2014 22:13, 2.7 КБайт)
Собственно не могу понять почему... - Re: Черная дыра
(А.П. Васи,
25.10.2014 15:26, 4.5 КБайт)
Ответ #208 : Сегодня... - Re: Черная дыра
(А.П. Васи,
25.10.2014 15:43, 585 Байт)
По большому счету достаточно странно... - Re: Черная дыра
(А.П. Васи,
27.10.2014 21:55, 580 Байт)
Вы случайно не перепутали балетный... - Re: Черная дыра
(А.П. Васи,
28.10.2014 13:15, 4.1 КБайт)
Ответ #109 : Сегодня... - Re: Черная дыра
(А.П. Васи,
28.10.2014 13:40, 1.1 КБайт)
А опыт очень простой, берётся... - Re: Черная дыра
(А.П. Васи,
31.10.2014 21:25, 52 Байт)
Уважаемые альты и релятивисты - всё будет нормально. - Re: Черная дыра
(А.П. Васи,
9.11.2014 15:07, 1.9 КБайт)
-------------------------------------------------------------------------Я аж смеялся, очень понравилось... - Re: Черная дыра
(А.П. Васи,
9.11.2014 15:26, 1.0 КБайт)
Собственно логично что релятивисты сольют воду на следующие вопросы.... - Re: Черная дыра
(А.П. Васи,
10.11.2014 20:32, 11.5 КБайт)
Ответ #800 : Сегодня... - Re: Черная дыра
(А.П. Васи,
10.11.2014 20:40, 715 Байт)
Ответ #804 : Сегодня... - Re: Черная дыра
(А.П. Васи,
10.11.2014 20:53, 555 Байт)
Я не понимаю что думают... - Re: Черная дыра
(А.П. Васи,
17.11.2014 21:03, 2.4 КБайт)
Детский сад слегка повзрослев... - Re: Черная дыра
(Albert Timashov,
20.11.2014 0:03, 826 Байт)
Черная дыра, наличие невидимого объекта... - Re: Черная дыра
(А.П. Васи,
20.11.2014 20:18, 527 Байт)
Както вечером хоть кто вдруг... - Re: Черная дыра
(А.П. Васи,
24.11.2014 19:53, 80 Байт)
17 - Re: Черная дыра
(А.П. Васи,
25.12.2015 20:10, 2.5 КБайт)
сразу перешёл с первого в третий класс.... - Re: Черная дыра
(А. В. Постников,
23.02.2016 6:02, 93 Байт)
я думаю что черных... - Re: Черная дыра
(Р. М. Ноев,
13.06.2016 23:08, 1.6 КБайт)
Когда статья начинается такими перлами, как "...... - Re: Черная дыра
(Р. М. Ноев,
13.06.2016 23:28, 1.9 КБайт)
Дубль второй (в котором исправлены... - Re: Черная дыра
(Р. М. Ноев,
17.05.2017 18:56, 449 Байт)
Более того, в продолжение...