|
А.В. Светлаков, М.В. Яманова, А.Б. Егорова, С.В. Михуткина
Красноярская государственная медицинская академия; Центр репродуктивной медицины,
Красноярск
[1] [2] [3] [4] [5]
[6] [7]
(Продолжение)В начало...
Семейство стероидных рецепторов представляет собой класс белков, функционирующих на ядерном уровне и являющихся, по существу, белками, регулирующими транскрипцию.
В отсутствие лигандов стероидные рецепторы находятся в комплексе с белками теплового шока hsp90 [84]. Активация рецепторов при связывании с гормоном приводит к диссоциации комплекса рецептор-белок теплового шока и димеризации рецептора. Димер обладает способностью связываться с соответствующими, строго специфичными для стероидов последовательностями ядерной ДНК, что обеспечивает селективность в отношении каждого из них и влияние на транскрипцию генов - мишеней [83].
Эстрогеновые, прогестероновые и глюкокортикостероидные рецепторы могут конкурировать за одни и те же общие транскрипционные факторы [16, 34, 82].
Большая часть гормон-рецепторных комплексов в ядре диссоциирует и инактивируется. В цитоплазму возвращаются свободный стероид и инактивированный под действием ядерных фосфатаз рецептор. Гормон, как правило, каким-либо изменениям не подвергается [7, 16].
Общепринятым является представление о том, что главным физиологическим регулятором экспрессии ядерных рецепторов внутри клеток-мишеней является уровень циркулирующих свободных гормонов [4].
Эстрадиол усиливает синтез собственных рецепторов, рецепторов прогестерона и рецепторов андрогенов. Прогестерон не только не усиливает синтез собственных рецепторов, но, напротив, подавляет его так же, как и синтез рецепторов эстрадиола. Следовательно, количество определенного вида рецепторов зависит как от содержания соответствующего активного гормона в крови, так и от концентрации стероидов других классов [7, 18].
В настоящее время обнаружены 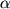 - и - и 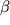 -типы эстрогеновых рецепторов. Первичная структура этих белков очень похожа, что позволяет предположить для них наличие общего механизма действия [7, 20]. -типы эстрогеновых рецепторов. Первичная структура этих белков очень похожа, что позволяет предположить для них наличие общего механизма действия [7, 20].
Наивысший уровень экспрессии 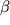 -рецептора обнаруживается в эпителиальных клетках эндометрия в преовуляторном периоде, а также в клетках стромы и эндотелиоцитах в позднюю секреторную фазу. Экспрессия -рецептора обнаруживается в эпителиальных клетках эндометрия в преовуляторном периоде, а также в клетках стромы и эндотелиоцитах в позднюю секреторную фазу. Экспрессия 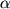 -рецепторов максимальна в течение периовуляторного периода. Показано, что экспрессия -рецепторов максимальна в течение периовуляторного периода. Показано, что экспрессия 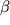 -рецепторов выражена значительно в меньшей степени, за исключением поздней секреторной фазы менструального цикла. Указывается на связь -рецепторов выражена значительно в меньшей степени, за исключением поздней секреторной фазы менструального цикла. Указывается на связь 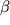 -рецепторов эстрогенов с активным ангиогенезом в этот период [52]. -рецепторов эстрогенов с активным ангиогенезом в этот период [52].
Рецептор прогестерона состоит из двух субъединиц - A и B в соотношении 1 : 1. Предполагается, что влияние прогестерона на эндометрий в секреторную фазу цикла и в ранние сроки беременности осуществляется, главным образом, посредством его воздействия на подтип А рецепторов, расположенных в клетках стромы эндометрия. Установлено, что уровень А- и В-изоформ по-разному регулируется в эндометрии в течение репродуктивного цикла. Прогестерон значительно увеличивает содержание А-изоформы, основной в децидуальных стромальных клетках. Эта же изоформа является более сильным активатором гена транспортного белка-1 (ИФРСБ-1) инсулиноподобных факторов роста-1 и -2 (ИФР-1 и -2) в эндометриальных стромальных клетках, чем В-изоформа рецептора прогестерона [7, 27].
Прогестерон обладает высоким сродством к своему рецептору, однако комплекс, который при этом образуется, диссоциирует и инактивируется достаточно быстро.
Все метаболиты прогестерона имеют меньшее сродство к рецептору, чем он сам [53]. Отмечено незначительное сродство эстрадиола, кортизола и тестостерона к рецепторам прогестерона.
В течение нормального менструального цикла содержание в эндометрии рецепторов к эстрогенам и прогестерону претерпевает закономерные колебания, синхронные с изменением концентрации эстрадиола и прогестерона в общем и маточном кровотоке [7, 60].
Данные литературы относительно динамики рецепторов стероидных гормонов в эндометрии в течение менструального цикла противоречивы. Одако большинство исследователей сходятся в том, что концентрация рецепторов к эстрогенам и прогестерону постепенно нарастает к периовуляторному периоду. Максимальное содержание рецепторов к прогестерону сохраняется до середины лютеиновой фазы. Общим результатом действия прогестерона во вторую фазу цикла является прогрессирующая дифференцировка клеток и завершение подготовки к приему бластоцисты. В преимплантационный период концентрация рецепторов к эстрогенам в эндометрии повышается [1, 6, 7]. Однако эстрогены в эту фазу могут оказывать лишь модулирующее влияние на генную экспрессию, обусловленную прогестероном [10, 79].
В норме наиболее высокая концентрация рецепторов, обладающих сродством к стероидным гормонам, отмечается в эндометрии в области дна матки и трубных углов [7].
Готовность эндометрия к имплантации бластоцисты определяется не только его рецепторной активностью, но и характерными морфологическими изменениями, во многом определяемыми процессом апоптоза клеток эндометрия [56].
Установлено, что апоптоз развивается в специфических популяциях клеток эндометрия в течение всего менструального цикла. В раннем пролиферативном эндометрии апоптозу подвергаются клетки функционального слоя. В позднюю пролиферативную фазу и вплоть до середины секреторной фазы признаков апоптоза в эндометрии не наблюдается [47].
В начале поздней секреторной фазы апоптоз вновь проявляется в стромальных клетках эндометрия. Началу апоптоза в железах и строме предшествует снижение концентрации 17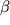 -эстрадиола и прогестерона в сыворотке крови, при этом увеличение апоптотического индекса в строме задерживается на 2 дня по сравнению с железами эндометрия. Снижение количества рецепторов к эстрогену и прогестерону в маточном эпителии обратно коррелирует с ростом апоптотического индекса в этих тканях. -эстрадиола и прогестерона в сыворотке крови, при этом увеличение апоптотического индекса в строме задерживается на 2 дня по сравнению с железами эндометрия. Снижение количества рецепторов к эстрогену и прогестерону в маточном эпителии обратно коррелирует с ростом апоптотического индекса в этих тканях.
Интенсивность процессов апоптоза увеличивается через 3-5 дней после пика прогестерона в середине лютеиновой фазы, затем происходит постепенное распространение процесса на все клеточные компоненты функционального слоя с достижением максимального уровня за 2 дня до начала менструации [47].
Одним из возможных механизмов ускорения апоптотических изменений в эндометрии является ишемия, возникающая вследствие спазма спиральных артерий перед началом кровотечения. Максимальный уровень процессов апоптоза сохраняется до 2-го дня менструального кровотечения [21, 78].
Клетки базального слоя не подвергаются апоптозу ни в одну из стадий менструального цикла [47].
Показано, что можно экспериментально моделировать запуск процессов апоптоза в эндометрии животных путем удаления стероидных гормонов [62]. Установлено, что активация апоптоза в эндометрии коррелирует с изменениями в концентрации 17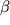 -эстрадиола и прогестерона всыворотке крови во время менструального цикла, концентрацией клеточных рецепторов к эстрогенам и прогестерону, а также с выраженностью пролиферативных и секреторных изменений эпителиальных и стромальных клеток эндометрия [21]. -эстрадиола и прогестерона всыворотке крови во время менструального цикла, концентрацией клеточных рецепторов к эстрогенам и прогестерону, а также с выраженностью пролиферативных и секреторных изменений эпителиальных и стромальных клеток эндометрия [21].
Показано участие апоптотических изменений эндометрия в ходе нормального процесса имплантации мышиных эмбрионов [40]. В течение имплантации эмбриона наблюдали развитие морфологических признаков апоптоза на участке имплантации в эндометрии. На 4-й день культивирования in vitro бластоцисты от беременной мыши было зафиксировано развитие апоптоза в клетках эпителия матки, прогрессирующего по мере роста трофобласта.
Вероятно, такое биологическое явление, как апоптоз, необходимо для нормального протекания стадий адгезии бластоцисты и инвазии трофобласта в ходе физиологической имплантации.
Далее...
Посмотреть комментарии[1]
| 
