Обычно словосочетание "гигантские молекулы" навевает мысли о
длиннющих
хитросплетениях органических соединений, о полимерах, белках, ДНК и
т.д.
Однако, в Природе есть много чудес. И одно из них - гигантские
молекулы,
состоящие всего из... двух атомов!
Пример тому - димер гелия, т.е. молекула He2. Всем
известно,
что гелий относится к инертным газам: он не вступает в химические
реакции,
не образует соединений. На языке атомной физики это означает, что
атом
гелия "не желает" делиться своими электронами и не хочет
"принимать"
чужие.
Уж очень устойчива полностью заполненная электронная оболочка атома
гелия!
Из-за такой инертности долгое время не было ясно, способен ли
гелий
образовывать хоть какие-нибудь соединения. В частности, долгое
время
стоял
вопрос: существует ли такое соединение как He2 вообще?
Способны
ли Ван-дер-Ваальсовы силы удержать два атома гелия вместе, или нет?
Надо
сказать, что это вопрос не из области праздного любопытства. Атом
гелия
- одна из самых простых систем в атомной физике и квантовой химии,
поэтому
теоретические вычисления из общих принципов могут здесь
претендовать
на
аккуратное описание эксперимента. Кроме этого, димер гелия - это
хорошая
проверка того, насколько правильно мы понимаем сами Ван-дер-
Ваальсовы
силы
на больших расстояниях.
В 1993 году были проведены первые масс-спектрометрические
эксперименты,
которые подтвердили существование димера He2.
Подтвердить-
то
подтвердили, но никакой другой информации об этой молекуле, - а
именно,
энергия связи, расстояние между атомами, наличие возбужденных
состояний
- получено не было. Это на самом деле вовсе не удивительно. Ведь
исходя
из того факта, что димер He2 не наблюдается даже при
низких
температурах (порядка 10 К), можно сделать вывод, что энергия связи
в
He2
значительно меньше, чем 10 К = 10-3 эВ. Для сравнения
скажем,
что энергия связи молекулы водорода составляет около 5 эВ. По этой
причине
методы исследования структуры молекул, ставшие уже привычными в
атомной
физике - оптическая, инфракрасная, рамановская спектроскопия,
дифракция
рентгеновских лучей, рассеяние электронов - здесь не годятся: они
попросту
разорвут молекулу. Так что, экспериментаторы вдруг встали перед
неожиданной
проблемой: как в принципе можно изучать столь хрупкую молекулу,
которая
буквально "рассыпается" на части от любого прикосновения?
Зачастую, когда "наукоемкие" методы анализа не работают, на
помощь
приходят
очень простые, даже примитивные методы. Так было и в случае
молекулы
He2.
В классических опытах 1996 года экспериментаторы "просеивали" атомы
гелия
через микроскопическое "сито" с отверстиями размером порядка 1000
ангстрем.
Это сито устанавливалось на пути пучка, состоявшего из атомов и
молекул
гелия, и затем подсчитывалось, какой процент атомов и какой процент
димеров
пролетает сквозь сито. Отверстия размером 1000 ангстрем, конечно,
достаточно
широки для того, чтобы пропустить как атомы, так и димеры. Однако в
случае
молекул He2 было одно "но": необходимо, чтобы оба атома
молекулы
He2 прошли, не задев за край отверстия. В противном
случае
-
молекула тут же разваливается на отдельные атомы. Поэтому
вероятность
прохождения
для димеров оказывается меньше, чем для отдельных атомов. Измеряя и
то,
и другое, и зная диаметр отверстия, можно определить размер самой
молекулы
He2. (Постарайтесь получить конкретные формулы
самостоятельно!)
Результаты эксперимента: длина связи He-He в димере оказалась
равной
60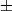 10 ангстрем. Это и в самом деле огромная
молекула:
расстояние
между
атомами превышает диаметр самих атомов в 100 раз! На момент
открытия,
связь
He-He была самой длинной химической связью из известных. Энергия
связи,
которая отвечает такому большому расстоянию, составляет всего
10-
7
эВ (или по температурной шкале, около 1 мК), т.е. в миллионы раз
слабее
типичных химических связей.
10 ангстрем. Это и в самом деле огромная
молекула:
расстояние
между
атомами превышает диаметр самих атомов в 100 раз! На момент
открытия,
связь
He-He была самой длинной химической связью из известных. Энергия
связи,
которая отвечает такому большому расстоянию, составляет всего
10-
7
эВ (или по температурной шкале, около 1 мК), т.е. в миллионы раз
слабее
типичных химических связей.
Отметим, что такая слабая связь позволяет двум атомам гелия
находиться
в связанном состоянии только с нулевым угловым моментом, т.е. не
вращаясь
друг вокруг друга. Другими словами, атомы гелия могут сидеть только
в
s-волне.
Возбужденные же уровни (вращательные или колебательные) у этой
молекулы
отсутствуют: попытка "перекинуть" молекулу в состояние с ненулевым
угловым
моментом сразу же ее разрушит.
Наконец, в совсем недавних экспериментах (сентябрь 2000 года)
длина
связи была измерена с еще лучшей точностью. В них исследовалась
дифракция
атомов и молекул гелия на дифракционной решетке нанометрового
масштаба.
Принципиальная идея здесь была та же: "эффективный" размер
отверстий
для
атомов и молекул различался. Эти новые измерения дали
52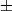 4
ангстрема.
4
ангстрема.
Ссылки:
F. Luo et al, J. Chem. Phys. 104 (1996) 1151; R.E.Grisenti et
al, Phys. Rev. Lett., 85 (2000) 2284
http://focus.aps.org/v6/st9.html
- краткий рассказ о недавнем определении длины связи в димере.
И.П.Иванов

