|
Ныс П.С., Курочкина В.Б., Скляренко А.В., Вейнберг Г.А. Государственный научный центр по антибиотикам, Москва, Россия, Латвийский институт органического синтеза, Рига,
Латвия
В начало...
(Продолжение)
Взаимосвязь структуры и биологической активности беталактамных соединений
1. Пенициллины
Гетероциклическим скелетом пенициллинов (1) является пенам (см. рис. 1, 3). Биологической активностью обладают только пенициллины, у которых С(5) атом в пенаме имеет R-конфигурацию. Рассмотрим влияние различных типов модификации пенама на биологическую активность получаемых производных [17, 18].
Окисление серы в положении S(1) пенама с образованием 1S-оксидов и 1S-сульфонов ослабляет антибактериальные свойства соединений. Однако введение второго атома кислорода приводит к получению соединений - необратимых ингибиторов бета-лактамаз.
Модификация заместителей в С(2) положении пенама с образованием 2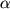 - и 2 - и 2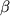 -ацетоксиметильных производных приводит к существенному падению антибактериальной активности. Удаление метильных групп в С(2) положении не оказывает влияния на активность соединений в отношении грамотрицательных, но снижает активность в отношении грамположительных микроорганизмов. -ацетоксиметильных производных приводит к существенному падению антибактериальной активности. Удаление метильных групп в С(2) положении не оказывает влияния на активность соединений в отношении грамотрицательных, но снижает активность в отношении грамположительных микроорганизмов.
Модификация карбоксильной группы в С(3) положении пенама, приводящая к ее удалению или образованию амидов, нитрилов, изоцианатов, альдегидов, спиртов и других производных, сопровождается резким снижением антибактериальной активности соединений. Все эти С(3) производные практического значения не имеют. Исключение составляют сложные эфиры, которые сами по себе также обладают очень низкой антибактериальной активностью, однако, благодаря наличию сложноэфирной связи, легко могут всасываться в кровь из желудочно-кишечного тракта и гидролизоваться in vivo под действием эстераз с образованием кислот, обладающих высокой активностью. В связи с этим они находят применение в качестве так называемых - проантибиотиков, которые легко всасываются при оральном введении.
Модификация в положении С(5) пенама приводит к полной потере антибактериальных свойств соединения, во-первых, из-за увеличения прочности ациламидной связи в беталактамном кольце и, во-вторых, из-за стерических затруднений при взаимодействии антибиотика с ПСБ.
Введение заместителей в С(6) положение пенама имеет ключевое значение с точки зрения создания новых лекарственных препаратов. Проводившаяся в начале 60-х годов интенсивная модификация N-ацильного фрагмента в 6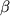 положении пенама привела к получению более 20 тыс. полусинтетических пенициллинов, из которых 37 получили широкое распространение как медицинские препараты. Полученные таким образом аминопенициллины превосходят природный антибиотик по активности и кислотостойкости, а пенициллины-кислоты (оксациллин, карбенициллин, метициллин и другие) - по устойчивости к бета-лактамазам, так как являются конкурентными ингибиторами этих ферментов. Замена амидной группы в 6 положении пенама привела к получению более 20 тыс. полусинтетических пенициллинов, из которых 37 получили широкое распространение как медицинские препараты. Полученные таким образом аминопенициллины превосходят природный антибиотик по активности и кислотостойкости, а пенициллины-кислоты (оксациллин, карбенициллин, метициллин и другие) - по устойчивости к бета-лактамазам, так как являются конкурентными ингибиторами этих ферментов. Замена амидной группы в 6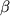 положении на амидиновую привела к созданию амидинопенициллинов, среди которых обнаружены соединения с выраженной активностью по отношению к грамотрицательным микроорганизмам. положении на амидиновую привела к созданию амидинопенициллинов, среди которых обнаружены соединения с выраженной активностью по отношению к грамотрицательным микроорганизмам.
2. Цефалоспорины
В отличие от природных пенициллинов природный цефалоспорин не обладает биологической активностью. Однако структурная модификация цефалоспорина, в первую очередь его 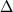 3-цефемного ядра (см. рис. 1, 3), радикально улучшает фармакологические свойства соединения. Практически все аналоги цефалоспорина, проявляющие биологическую активность, имеют 6R и 7R конфигурацию соответствующих углеродных атомов. 3-цефемного ядра (см. рис. 1, 3), радикально улучшает фармакологические свойства соединения. Практически все аналоги цефалоспорина, проявляющие биологическую активность, имеют 6R и 7R конфигурацию соответствующих углеродных атомов.
Рассмотрим влияние различных типов модификации 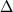 3-цефема на биологическую активность получаемых производных [17, 19, 20]. 3-цефема на биологическую активность получаемых производных [17, 19, 20].
Модификация 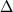 3-цефема в S(1) положении с образованием 3-цефема в S(1) положении с образованием 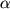 - и - и 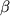 -сульфоксидов цефалоспорина приводит к снижению биологической активности, причем -сульфоксидов цефалоспорина приводит к снижению биологической активности, причем 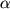 -изомер активнее -изомер активнее 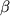 -изомера. -изомера.
Модификация 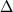 3-цефема в С(2) положении с образованием алкоксигрупп сопровождается снижением антибактериальных свойств по мере увеличения алкильного заместителя. 3-цефема в С(2) положении с образованием алкоксигрупп сопровождается снижением антибактериальных свойств по мере увеличения алкильного заместителя.
Структурная модификация заместителя в С(3) положении 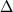 3-цефема является одним из основных способов воздействия на антибактериальные свойства антибиотика. Заместитель в С(3) положении оказывает также существенное влияние на фармакокинетические свойства соединения. Эти заместители характеризуются большим структурным многообразием, прежде всего благодаря использованию различных азот- и серусодержащих гетероциклических систем. Создание цефалоспоринов IV поколения связано с введением в С(3) положение иминоцефалоспоринов гетероциклических заместителей с четвертичным аммонийным азотом [21], что привело к увеличению активности соединений, особенно в отношении грамотрицательных бактерий (например, первые цефалоспорины IV поколения цефепим и цефпиром) [12]. Повышение антипсевдомонадной активности за счет улучшения клеточной проницаемости было достигнуто путем введения заместителя (4-карбомоил-1-хинуклидин) в С(3) положение иминоцефалоспоринов (цефклидин) [12]. 3-цефема является одним из основных способов воздействия на антибактериальные свойства антибиотика. Заместитель в С(3) положении оказывает также существенное влияние на фармакокинетические свойства соединения. Эти заместители характеризуются большим структурным многообразием, прежде всего благодаря использованию различных азот- и серусодержащих гетероциклических систем. Создание цефалоспоринов IV поколения связано с введением в С(3) положение иминоцефалоспоринов гетероциклических заместителей с четвертичным аммонийным азотом [21], что привело к увеличению активности соединений, особенно в отношении грамотрицательных бактерий (например, первые цефалоспорины IV поколения цефепим и цефпиром) [12]. Повышение антипсевдомонадной активности за счет улучшения клеточной проницаемости было достигнуто путем введения заместителя (4-карбомоил-1-хинуклидин) в С(3) положение иминоцефалоспоринов (цефклидин) [12].
Введение сложноэфирной защиты карбоксильной группы в С(4) положении 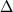 3-цефема, отщепляемой неспецифическими эстеразами сыворотки крови, позволяет получать процефалоспорины. Это, также как и в случае пропенициллинов, существенно улучшает фармакокинетические характеристики препаратов. 3-цефема, отщепляемой неспецифическими эстеразами сыворотки крови, позволяет получать процефалоспорины. Это, также как и в случае пропенициллинов, существенно улучшает фармакокинетические характеристики препаратов.
Введение заместителей в С(6) положение 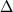 3-цефема приводит к полной потере антибактериальных свойств цефалоспоринов. 3-цефема приводит к полной потере антибактериальных свойств цефалоспоринов.
Положение С(7) 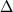 3-цефема является ключевым с точки зрения создания новых лекарственных препаратов. Также как и в случае пенициллинов, структурная модификация N-ацильного фрагмента в 7 3-цефема является ключевым с точки зрения создания новых лекарственных препаратов. Также как и в случае пенициллинов, структурная модификация N-ацильного фрагмента в 7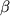 положении цефема является наиболее радикальным способом воздействия на антибактериальные свойства антибиотика. Например, введение в С(7) положение положении цефема является наиболее радикальным способом воздействия на антибактериальные свойства антибиотика. Например, введение в С(7) положение 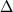 3-цефема заместителя на основе 2(N-защищенной-2-аминотиазол-4-ил)-2(Z)-(метоксиимино)уксусной кислоты привело к созданию цефалоспоринов III поколения (иминоцефалоспоринов) с расширенным спектром антибактериальной активности и проявляющих более высокую по сравнению с цефалоспоринами II поколения активность в отношении грамотрицательных бактерий (например, цефотаксим, цефтазидим) [12]. Введение метокси- и N-формиламиногруппы в 7 3-цефема заместителя на основе 2(N-защищенной-2-аминотиазол-4-ил)-2(Z)-(метоксиимино)уксусной кислоты привело к созданию цефалоспоринов III поколения (иминоцефалоспоринов) с расширенным спектром антибактериальной активности и проявляющих более высокую по сравнению с цефалоспоринами II поколения активность в отношении грамотрицательных бактерий (например, цефотаксим, цефтазидим) [12]. Введение метокси- и N-формиламиногруппы в 7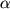 положение цефема придает соединениям устойчивость к бета-лактамазам [20]. положение цефема придает соединениям устойчивость к бета-лактамазам [20].
Ядерные аналоги цефалоспоринов. Замена атома серы в положении S(1) цефема на кислород, а также перемещение заместителя в 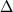 3-цефеме из положения С(3) в положение С(2) приводят к значительному увеличению антибактериальной активности цефалоспоринов. 3-цефеме из положения С(3) в положение С(2) приводят к значительному увеличению антибактериальной активности цефалоспоринов.
3. Пенемы и карбапенемы
Пенемы (5) и карбапенемы (7) представляют собой два близких в структурном отношении типа беталактамных антибиотиков, гетероциклический скелет которых образуют соответственно пенем и карбапенем (см. рис. 1, 3). Как и в случае пенициллина, антибактериальной активностью обладают производные, имеющие R-конфигурацию С(5) атома. Рассмотрим влияние некоторых видов модификации пенемов и карбапенемов на биологическую активность производных [22].
Включение кислорода в положение S(1) пенема приводит к получению 1-окса-2-пенемов - нестойких в химическом отношении веществ, являющихся эффективными ингибиторами бета-лактамаз.
Введение метильной группы в С(1)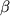 положение карбапенема приводит к стабилизации антибиотика по отношению к действию дегидропептидаз почек. положение карбапенема приводит к стабилизации антибиотика по отношению к действию дегидропептидаз почек.
Варьирование структуры заместителя в С(2) положении пенема оказывает незначительное воздействие на биологические свойства антибиотика. Наибольшую активность проявляют пенемы, содержащие в С(2) положении тиоэтильную или карбамоилоксиметильную группы.
Модификация карбапенема в С(2) положении может приводить к повышению кислотостойкости производных, а также увеличению их устойчивости к действию бета-лактамаз. Введение амидиновой группы в 2-тиоэтильный фрагмент карбапенема повышает активность антибиотика в отношении грамотрицательных бактерий.
С(6) положение в пенеме и карбапенеме. Характерной особенностью обоих этих беталактамов, отличающей их от пенициллинов, является наличие у них широкого спектра антибактериального действия даже в отсутствии заместителя в С(6) положении. Более того, 6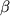 -ациламидные производные пенема и карбапенема химически не стабильны и биологически не активны. Наилучшими антибактериальными свойствами обладают производные пенема и карбапенема, содержащие 1R-гидроксиэтильную группу в 6 -ациламидные производные пенема и карбапенема химически не стабильны и биологически не активны. Наилучшими антибактериальными свойствами обладают производные пенема и карбапенема, содержащие 1R-гидроксиэтильную группу в 6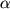 положении антибиотика. Она защищает беталактамное кольцо и обеспечивает стабильность антибиотиков в отношении действия бета-лактамаз. положении антибиотика. Она защищает беталактамное кольцо и обеспечивает стабильность антибиотиков в отношении действия бета-лактамаз.
Далее...
Написать комментарий
| 
