|
А.В. Никитин Государственный научный центр по антибиотикам, Москва
В начало...
Достижения биотехнологии и химико-фармацевтической отрасли медицинской промышленности во многом способствовали разработке и внедрению в практику эффективных антибиотиков и синтетических химиопрепаратов. Существенными предпосылками оптимизации лечебно-профилактических мероприятий являются комплексное изучение механизмов патогенеза, оценка химиотерапевтической эффективности, фармакокинетики, исследование фармакотоксикологических и иммунофармакологических свойств новых лекарственных средств. Одним из интенсивно развивающихся в последние годы направлений исследований, является изучение иммуномодулирующего и противовоспалительного действия антибиотиков и синтетических химиопрепаратов. Анализ клеточных и молекулярных механизмов воспалительных реакций, как правило, сопутствующих любому инфекционному процессу, позволили установить связь иммунореактивности организма с развитием воспаления, выделить ряд устойчивых факторов его патогенеза и выявить в большинстве случаев много общих показателей кинетики популяций клеток-эффекторов и различных медиаторов, а также их взаимодействий не только при инфекционной патологии, но и при аутоиммунных заболеваниях, тяжелых травмах, хирургических вмешательствах, ожогах, заболеваниях печени, почек, сердечно-сосудистой и дыхательной систем, опухолевых процессах и т.д. Воспалительные реакции, развивающиеся в результате первичной активации клеток иммунной системы (макрофагов, моноцитов, Т-лимфоцитов) под действием различных стимулов во многом сходны, что имеет большое значение для определения путей селективной регуляции отдельных звеньев и этапов воспаления при различной патологии. Современные химиотерапевтические средства из групп цефалоспоринов, макролидов и фторхинолонов наряду с высокой химиотерапевтической эффективностью оказывают положительное иммунотропное действие: стимулируют фагоцитоз и внутриклеточную деструкцию возбудителей, повышают гуморальный и клеточный иммунный ответ [1, 2]. Цефалоспориновые антибиотики (цефтазидим и др.) нормализуют соотношение про- и противовоспалительных цитокинов, уменьшают уровень активных форм кислорода и защищают биологические макромолекулы от оксидативного стресса при воспалении [1]. Макролидные антибиотики (кларитромицин, рокситромицин и др.) также характеризуются противоспалительным действием, в частности, за счет уменьшения высвобождения провоспалительных цитокинов [1-3]. Препараты группы тетрациклинов тормозят возрастающую при воспалении активность различных металлопротеиназ, разрушающих структурные компоненты тканей [3].
Дополнительным фактором повышения эффективности химиотерапии, наряду с собственным противовоспалительным действием антибиотиков, может стать применение различных иммуно- и фармакопрепаратов, регулирующих каскад воспалительных реакций. В более широком аспекте регуляция высвобождения и активности различных медиаторов воспаления имеет высокую актуальность и для лечения ряда состояний, не сопровождающихся микробной инвазией или бактериемией, но также приводящих к возникновению синдромов острой системной воспалительной реакции или множественной дисфункции органов. В любом случае обоснованное применение средств и методов патогенетической терапии должно строиться на адекватной оценке роли отдельных звеньев воспалительного процесса.
В развитии воспаления, в том числе и острых воспалительных реакций, включая сепсис, ведущую роль играют цитокины, система комплемента, факторы свертывания крови, кинины, вазоактивные медиаторы, продукты метаболизма арахидоновой кислоты (простагландины, тромбоксаны и лейкотриены), фактор активации тромбоцитов (ФАТ), эндотелины, гистамин, эндорфины, активные формы кислорода, оксид азота [4]. Динамика и взаимосвязь указанных факторов весьма сложны. В еще большей степени модель воспалительной реакции усложняется при в включении в круг рассматриваемых факторов различных фармакологических агентов, применяемых в этиотропной и патогенетической терапии. При бактериальных, вирусных или грибковых инфекциях основными индукторами воспалительной реакции являются структурные компоненты микрорганизмов или продукты их жизнедеятельности.
На сеть цитокинов оказывают существенное влияние компоненты грамотрицательных микроорганизмов: липополисахарид (ЛПС), липид А и связанные с ним белки, порины, белки внешней мембраны, шаперонины. Среди компонентов грамотрицательных микрорганизмов, воздействующих на цитокины, выделяют липоарабиноманнан, липоманнан, белки теплового шока микобактерий, белок А, липотейхоевую кислоту. На выделение цитокинов могут оказывать влияние структурные компоненты клеточных стенок грамотрицательных и грамположительных бактерий - поверхностные белки, фимбрии и пили, липопептиды, мурамилдипептид, пептидогликаны и полисахариды. Адгезия бактерий на клетках макроорганизма также может стимулировать выделение цитокинов [5].
При адгезии Salmonella typhimurium на макрофагах мышей происходит стимуляция экспрессии мРНК, кодирующих ИЛ-1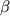 , ИЛ-6, гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМКСФ) и хемокины MIP-1 , ИЛ-6, гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМКСФ) и хемокины MIP-1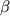 и MIP-2, а также фактор роста меланоцитов, а при адгезии данного вида бактерий на клетках эпителия кишечника человека повышается выделение ИЛ-8. Адгезия Legionella pneumophila на макрофагах мышей сопровождается усилением транскрипции генов, кодирующих ИЛ-1 и MIP-2, а также фактор роста меланоцитов, а при адгезии данного вида бактерий на клетках эпителия кишечника человека повышается выделение ИЛ-8. Адгезия Legionella pneumophila на макрофагах мышей сопровождается усилением транскрипции генов, кодирующих ИЛ-1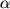 , ИЛ-1 , ИЛ-1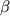 , ИЛ-6, ФНО- , ИЛ-6, ФНО-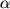 и ГМКСФ. Адгезия уропатогенных штаммов Escherichia coli вызывает у мышей повышенное образование ИЛ-1 и ГМКСФ. Адгезия уропатогенных штаммов Escherichia coli вызывает у мышей повышенное образование ИЛ-1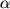 , ИЛ-6, ИЛ-8. Воздействие ИЛ-6 повышает чувствительность нейтрофилов к стимулирующему действию пептида формил-метионил-фенилаланил-лейцина (ФМФЛ) и усиливает образование IgA в IgA-коммитированных В-лимфоцитах. ИЛ-1 и ИЛ-8 повышают образование активных форм кислорода в полиморфноядерных лейкоцитах (ПЯЛ ) под действием ФМФЛ и рекрутируют ПЯЛ в очаг инфекции. Helicobacter рylori индуцирует экспрессию цитокинов в эпителиальных клетках и повышает уровень мРНК для ИЛ-6, ИЛ-7 , ИЛ-8, ИЛ-10, и ФНО- , ИЛ-6, ИЛ-8. Воздействие ИЛ-6 повышает чувствительность нейтрофилов к стимулирующему действию пептида формил-метионил-фенилаланил-лейцина (ФМФЛ) и усиливает образование IgA в IgA-коммитированных В-лимфоцитах. ИЛ-1 и ИЛ-8 повышают образование активных форм кислорода в полиморфноядерных лейкоцитах (ПЯЛ ) под действием ФМФЛ и рекрутируют ПЯЛ в очаг инфекции. Helicobacter рylori индуцирует экспрессию цитокинов в эпителиальных клетках и повышает уровень мРНК для ИЛ-6, ИЛ-7 , ИЛ-8, ИЛ-10, и ФНО-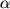 . Бактериальная инвазия часто способствует выделению цитокинов. При инвазии Salmonella dublin, Yersinia enterocolitica, Shigella dysenteriae, Listeria monocytogenes в эпителиальные клетки повышается выделение ИЛ-8, моноцитарного хемотаксического белка МСР-1, ГМКСФ и ИЛ-1 . Бактериальная инвазия часто способствует выделению цитокинов. При инвазии Salmonella dublin, Yersinia enterocolitica, Shigella dysenteriae, Listeria monocytogenes в эпителиальные клетки повышается выделение ИЛ-8, моноцитарного хемотаксического белка МСР-1, ГМКСФ и ИЛ-1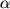 , ИЛ-1 , ИЛ-1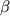 , ФНО- , ФНО-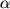 , индуцирующих воспалительную реакцию. ИЛ-8 и МСР-1 являются сильными хемоаттрактантами, в то время как ГМКСФ усиливает жизнеспособность клеток-эффекторов воспаления и повышает их чувствительность к провоспалительным цитокинам. , индуцирующих воспалительную реакцию. ИЛ-8 и МСР-1 являются сильными хемоаттрактантами, в то время как ГМКСФ усиливает жизнеспособность клеток-эффекторов воспаления и повышает их чувствительность к провоспалительным цитокинам.
Инвазия S.aureus в клетки эндотелия пупочной вены человека стимулирует высвобождение ИЛ-1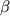 и ИЛ-6, а при внедрении S.flexneri или инвазивных штаммов E.coli в фибробласты человека отмечено повышение образования ИФ- и ИЛ-6, а при внедрении S.flexneri или инвазивных штаммов E.coli в фибробласты человека отмечено повышение образования ИФ-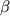 .Применение в этих условиях рифампина оказывает подавляющее действие на синтез цитокинов. При заражении S.flexneri макрофагов усиливается их апоптоз, сопровождающийся выделением ИЛ-1 .Применение в этих условиях рифампина оказывает подавляющее действие на синтез цитокинов. При заражении S.flexneri макрофагов усиливается их апоптоз, сопровождающийся выделением ИЛ-1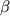 . Механизм этого явления связан с тем, что антиген плазмиды инвазии В непосредственно взаимодействует с ИЛ-1 . Механизм этого явления связан с тем, что антиген плазмиды инвазии В непосредственно взаимодействует с ИЛ-1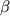 - превращающим ферментом (ИЛ-1 - превращающим ферментом (ИЛ-1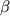 -ПФ) и активирует переход неактивного предшественника ИЛ-1 -ПФ) и активирует переход неактивного предшественника ИЛ-1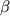 в его активную форму. Способностью к индукции цитокинов характеризуются также продукты деградации молекул ряда белков организма. При воздействии протеазы Porphyromonas gingivalis могут образовываться Fc-фрагменты IgG1, которые стимулируют выделение ИЛ-6, ИЛ-8 и ФНО - в его активную форму. Способностью к индукции цитокинов характеризуются также продукты деградации молекул ряда белков организма. При воздействии протеазы Porphyromonas gingivalis могут образовываться Fc-фрагменты IgG1, которые стимулируют выделение ИЛ-6, ИЛ-8 и ФНО -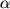 из моноцитов периферической крови. В ряде случаев, например, при воздействии стрептококкового пирогенного экзотоксина В (СПЭВ), являющегося цистеиновой протеазой со свойствами близкими к таковым ИЛ-1 из моноцитов периферической крови. В ряде случаев, например, при воздействии стрептококкового пирогенного экзотоксина В (СПЭВ), являющегося цистеиновой протеазой со свойствами близкими к таковым ИЛ-1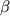 -ПФ (капсазы 1) возможно образование ИЛ-1 -ПФ (капсазы 1) возможно образование ИЛ-1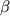 из его предшественника. Однако между специфичностью действия капсазы 1 и СПЭВ имеются определенные различия. Так, капсаза 1 расщепляет пре-ИЛ-1 из его предшественника. Однако между специфичностью действия капсазы 1 и СПЭВ имеются определенные различия. Так, капсаза 1 расщепляет пре-ИЛ-1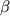 между Asp 116 и Ala 117, а СПЭВ - между His 115 и Asp 116. В последнем случае ИЛ-1 между Asp 116 и Ala 117, а СПЭВ - между His 115 и Asp 116. В последнем случае ИЛ-1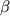 приобретает дополнительную аминокислоту, что придает ему новый вид биологического действия - способность стимулировать активность индуцибельной синтетазы оксида азота в гладкомышечных клетках и оказывать цитотоксическое действие на клетки меланомы А 375. Фермент, сходный со СПЭВ, был также обнаружен в мононуклеарных клетках периферической крови человека. приобретает дополнительную аминокислоту, что придает ему новый вид биологического действия - способность стимулировать активность индуцибельной синтетазы оксида азота в гладкомышечных клетках и оказывать цитотоксическое действие на клетки меланомы А 375. Фермент, сходный со СПЭВ, был также обнаружен в мононуклеарных клетках периферической крови человека.
Далее...
Написать комментарий
|

