|
Показано, что соединения серы и фосфора (тиосульфат натрия, триполифосфат натрия, гексаметафосфат натрия, кислый однозамещенный фосфат натрия) катализируют реакцию цис-транс-изомеризации ароматических гептаенов. Предложена препаративная методика изомеризации леворина в присутствии тиосульфата натрия. Выделенный продукт реакции представляет собой полностью транс-изомер. Ключевые слова:
Ранее было показано, что ароматические гептаены изомеризуются под действием УФ-света с длиной волны 365 нм (прямое возбуждение хромофора антибиотика, синглет-синглетный перенос энергии) и 313 нм (внутримолекулярный перенос энергии с ароматического фрагмента на хромофор, триплет-триплетный перенос энергии). В первом случае реакция является равновесной и квантовый выход весьма мал (0,003 квант-1), во втором случае реакция была необратимой и квантовый выход был на 2 порядка выше (0,12-0,15 квант-1) [1-5]. Фотохимическая реакция с квантовым выходом, близким к единице, была достигнута с использованием сенсибилизаторов-красителей при облучении растворов ароматических гептаеновых антибиотиков видимым светом [6, 7]. Полученные изомеры имели полностью транс-конфигурацию и обладали биологической активностью в 2-4 раза большей, чем биологическая активность исходных препаратов.
В настоящем сообщении приводятся данные об изучении стереоизомеразации ароматических гептаеновых антибиотиков, катализируемой соединениями, содержащими в своем составе серу и фосфор.
Электронные спектры поглощения измеряли на спектрофотометре "Hitachi ESP-3" (Япония), ИК-спектры записывали на спектрометре IR-20 (Германия), удельное вращение измеряли на спектрополяриметре AI-СПУ (Россия), кинетику фотоизомеризации изучали на установке, описанной ранее [3], химическую изомеризацию и температурную зависимость исследовали в термостатированной кювете, встроенной в спектрофотометр.
Объектами исследований служили леворин с Е1%1 см = 845 при 380 нм, леворин А2 с Е1%1 см = 1000, трихомицин с Е1%1 см = 915 и кандицидин с Е1%1 см = 875. Биологическую активность исходных соединений и продуктов изомеризации определяли с тест-культурой Candida albicans методом последовательных разведений.
Для исследования изомеризации леворина А2 к раствору последнего в 67% ацетоне или в 88% водном бутаноле (концентрация 0,5?10-3 моль/л) добавляли 5% водный раствор соединений серы или фосфора из расчета 0,005 моль/л. Раствор помещали в цилиндрическую термостатированную кювету (l = 0,2 см) и проводили измерения оптической плотности раствора при длинах волн 406 и 382 нм в динамике. Вычисляли отношение оптических плотностей растворов и строили кинетическую кривую зависимости D406/D382 от времени.
Для препаративного получения изолеворина 1 г леворина растворяли в 1 л 67% ацетона, содержащего 0,2% тиосульфата натрия (в темноте). Раствор выдерживали при температуре 40 ?С в течение часа, записывая через каждые 10 мин УФ-спектр в интервале 300-400 нм. Об окончании равновесной реакции судили по установившейся постоянной оптической плотности раствора. После окончания реакции образовавшийся изолеворин осаждали водой в отношении 1:2, суспензию выдерживали в холодильнике в течение ночи. Осадок промывали небольшим количеством воды, дважды ацетоном, эфиром и сушили в вакуум-эксикаторе. Выход 85%.
В аналогичных условиях проводили изомеризацию трихомицина и кандицидина.
Стереоизомеразация полиенов, вследствие большой стереоспецифичности биологических процессов, приводит к изменению их биологических свойств. Многочисленные примеры стереоизомеразации полиенов можно встретить в области каротиноидов, высших жирных кислот и других этиленовых соединений. В случае биологических объектов очень важными являются процессы, связанные с фотохимическими превращениями. Но наряду с фотоизомеризацией широко применяется цис-транс-изомеразация, катализируемая различными химическими агентами. В качестве катализаторов цис-транс-изомеризации используются химические элементы V и VI групп (соединения фосфора, серы, селена и др.), парамагнитные соединения (платина, палладий и др.), галогены и свободно-радикальные катализаторы, кислоты и щелочи [8, 9].
Представляло интерес проверить влияние вышеназванных катализаторов на процесса стереоизомеризации ароматических гептаеновых антибиотиков, имеющих в своем хромофоре цис-двойную связь.
Применительно к полиеновым антибиотикам в литературе имеются данные только для трихомицина А. При обработке последнего уксусной кислотой был выделен продукт реакции со спектром поглощения, характерным для полностью транс-гептаена [10].
На примере леворина нами было показано, что присутствие в растворах последнего галогенов, следов кислот и щелочей не приводит к изомеризации леворина. Во всех случаях мы наблюдали плавное уменьшение экстинкции всех трех максимумов поглощения, коррелирующее с падением биологической активности.
Наиболее интересные результаты были получены при использовании в качестве катализаторов соединений серы и фосфора. Катализирующий эффект был изучен на примере следующих солей: тиосульфата натрия, кислого однозамещенного фосфата натрия, триполифосфата натрия и гексаметафосфата натрия (рис. 1). Во всех случаях в определенных условиях мы наблюдали цис-транс-изомеризацию леворина. Наиболее специфическое действие на реакцию оказывал тиосульфат натрия. Было отмечено, что при выдерживании растворов леворина А2 при 30 ?С и выше в присутствии тиосульфата натрия наблюдается сдвиг максимумов поглощения в длинноволновую область спектра и увеличение экстинкции при 406 нм. При этом оказалось, что свежеприготовленный раствор тиосульфата натрия не катализирует реакцию изомеризации. Напротив, изомеризация леворина ускоряется, если использовать раствор тиосульфата натрия, предварительно выдержанный на свету в течение часа или же облученный УФ-светом (рис. 2).
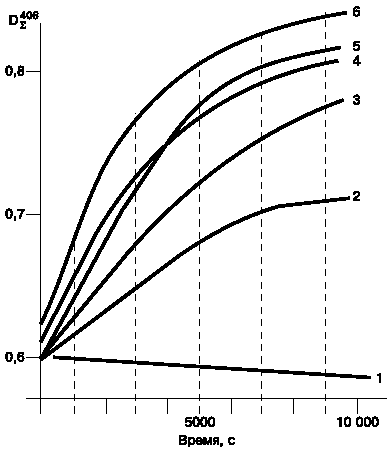 |
Рис. 1. Влияние присутствия соединений серы и фос-фора в водно-ацетоновом растворе (67%) на скорость цис-транс-изомеризации леворина А2.
По оси ординат - суммарная оптическая плотность раствора при 406 нм; по оси абсцисс - время наблюдения, сек.
1 - исходный леворин А2 (без добавки катализатора); 2 - леворин А2 в присутствии триполифосфата натрия; 3 - в присутствии гексаметафосфата натрия; 4 - в присутствии диспергированной серы; 5 - в присутствии кислого однозамещенного фосфата натрия; 6 - в присутствии тиосульфата натрия. Концентрация леворина А2 0,5?10-3 моль/л, концентрация соединений серы и фосфора во всех случаях составляла 0,005 моль/л. |
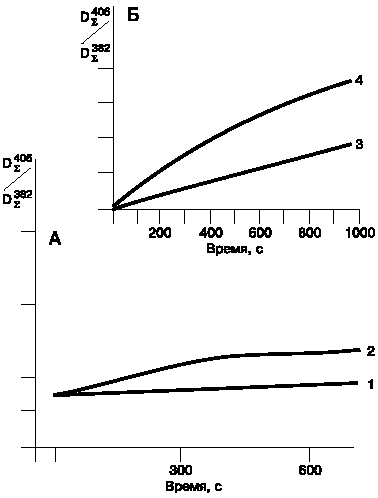 |
Рис. 2. Кинетические кривые изомеризации леворина А2.
А: 1 - в присутствии свежеприготовленного тиосульфата натрия; 2 - в присутствии тиосульфата натрия, предварительно подвергнутого фотолизу. Температура инкубации 20 ?С.
Б: 3 - в присутствии тиосульфата натрия, предварительно подвергнутого фотолизу, температура инкубации 30 ?С; 4 - то же, при температуре инкубации 45 ?С. |
Оптимальной для реакции была температура 40-60 ?С и концентрация тиосульфата натрия 0,2-0,5%. При более высоких температурах начинают преобладать процессы деструкции хромофора антибиотика. Процесс изомеризации носит равновесный характер и заканчивается в течение 40-60 мин. Скорость изомеризации леворина А2 была пропорциональна концентрации катализатора и температуре. Показано также, что при аналогичных условиях изомеризуются ароматические гептаены трихомицин и кандицидин.
Изомеризованный леворин выделяли по известной методике [2]. Его характеристика представлена в таблице.
| Таблица. Характеристика леворина А2 и продукта его изомеризации |
| Антибиотик |
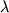 макс(E1%1 см) макс(E1%1 см) |
[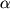 ]D ]D |
МПK, мкг/мл |
| Леворин А2 |
358 (706) |
+85? (с 0,1, ДМСО) |
0,050 |
| 378 (1050) |
+150? (пиридин) |
| 400 (883) |
|
| Изомеризованный продукт |
362 (723) |
+270? (с 0,1, ДМСО) |
0,008 |
| 382 (1100) |
+8? (пиридин) |
| 406 (1180) |
|
В ИК-спектре изомеризованного продукта наблюдали уменьшение интенсивности полосы при 765 см-1 (цис-полоса) и возрастание интенсивности полосы при 1010 см-1 (транс-полоса). Продукты изомеризации отличались от исходных антибиотиков также меньшей растворимостью, что характерно для полностью транс-изомеров гептаеновых антибиотиков [4]. Биологическая активность продуктов изомеризации превосходила таковую исходных соединений в 2 и более раз.
Полученные данные позволяют утверждать, что в процессе выдерживания растворов ароматических гептаенов в присутствии соединений серы и фосфора имеет место цис-транс-изомеризация с образованием полностью транс-изомера.
Следует заметить, что соединения фосфора и серы ускоряют процесс фотоизомеризации ароматических гептаенов при облучении их растворов УФ-светом с длиной волны 365 нм. Ускорение фотохимической реакции в присутствии тиосульфата натрия происходило 1,3 раза (рис. 3). В этом случае наблюдались те же закономерности: скорость фотореакции повышалась при повышении температуры и повышении концентрации катализатора.
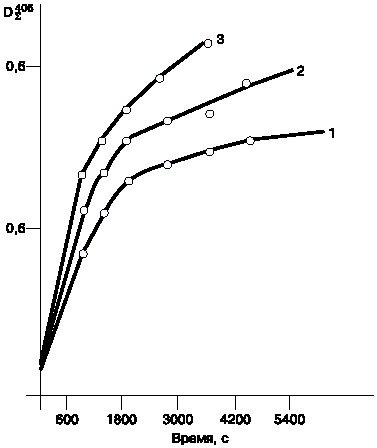 |
Рис. 3. Кинетические кривые фотоизомеризации леворина А2 под действием УФ-света с длиной волны 365 нм в присутствии соединений серы и фосфора.
1 - исходный леворин А2 (без добавки катализатора); 2 - леворин А2 в присутствии однозамещенного фосфата натрия; 3 - в присутствии тиосульфата натрия. |
Полученные данные, с одной стороны, следует учитывать при разработке технологии получения ароматических гептаенов, и, с другой - можно рассматривать как основу метода получения более активного и стабильного препарата.
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 2000-N6, стр. 7-9.
1. А.с. 563817; 1976: СССР.
2. Филиппова А.И., Соловьев С.Н., Шенин Ю.Д. и др. Антибиотики 1972; 10: 932-937.
3. Филиппова А.И., Лашков Г.И., Козел С.П., Шенин Ю.Д. Там же 1987; 8: 749-754.
4. Шенин Ю.Д., Филиппова А.И. Там же 5: 333-337.
5. Пат. 5244661 1990, США (приор. Япония N 1-106167; 1989).
6. Шенин Ю.Д., Филиппова А.И. Антибиотики и химиотер 1994; 12: 12-18.
7. Шенин Ю.Д., Филиппова А.И. Там же 1997; 2: 16-21.
8. Conia J.M., Denis J.N. Tetrahedron Lett 1971; 2845-2860.
9. Heine H.G. Chem Ber 1971; 104: 2869-2881.
10. Nakano N. J Antibiot 1961; 14: 68-85.
Написать комментарий
|

