|
Степаншин Ю.Г., Степаншина В.Н., Шемякин И.Г. Государственный научный центр прикладной микробиологии, п. Оболенск, Московская обл.
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 1999-N4, стр. 39-43.
В начало...
Рост заболеваемости туберкулезом в последнее десятилетие - одна из драматических страниц истории человечества. По прогнозам ВОЗ, к 2000 году количество вновь выявленных случаев заболевания туберкулезом может составить 90 млн, и, если мероприятия по борьбе с этой инфекцией не станут более эффективными, можно ожидать гибели от нее приблизительно 30 млн человек.
Другой стороной проблемы туберкулеза является развитие у ее возбудителя - Mycobacterium tuberculosis и других микобактерий туберкулезного комплекса лекарственной устойчивости. Поток сообщений о выявлении у больных туберкулезом микобактерий, устойчивых к одному, двум или нескольким противотуберкулезным препаратам, постоянно нарастает. Анализ данных литературы свидетельствует о распространении лекарственноустойчивых штаммов возбудителя туберкулеза практически во всем мире. По мнению американских исследователей [1, 2], в США было уже несколько эпидемий туберкулеза, вызванных множественноустойчивыми штаммами M.tuberculosis. Совершенно очевидно, что это является серьезным препятствием для химиотерапии туберкулеза, которой отводится основное место в борьбе с этим заболеванием.
Результаты многочисленных исследований, посвященных устойчивости M.tuberculosis к лекарственным препаратам, свидетельствуют о том, что лежащие в ее основе молекулярные механизмы принципиально не отличаются от уже известных для большинства других бактерий [3-5].
Развитие устойчивости у M.tuberculosis к ряду противотуберкулезных препаратов показывает, что уровень устойчивости бактериальной культуры находится в зависимости от концентрации используемого для лечения препарата. При повышении последней повышается и уровень устойчивости бактериальной культуры. Сходная картина наблюдается при монотерапии инфекции с последовательной сменой препаратов при неэффективном лечении. В результате можно отобрать штамм микроба, у которого последовательно развилась устойчивость к нескольким препаратам. Это объясняет возникновение устойчивых к одному препарату и множественноустойчивых штаммов в клинической практике [6, 7]. Скорость развития устойчивости коррелирует с частотой возникновения в бактериальной хромосоме мутаций, обусловливающих устойчивость к тому или иному лекарственному средству. В конечном же итоге появление лекарственноустойчивых штаммов M.tuberculosis определяется эффективностью селекции мутантов бактерий, обладающих определенным уровнем устойчивости к тому или иному антимикробному препарату. Частота появления мутантов с лекарственной устойчивостью различна и колеблется от 10-6 для рифампицина и изониазида, 10-8 для стрептомицина и до 10-9 - для препаратов группы фторхинолонов [8, 9].
Таким образом, вероятность возникновения и отбора устойчивых штаммов в больших популяциях микобактерий достаточно высока. В легочных кавернах диаметром 2,5 см обнаруживают около 108 бактерий возбудителя туберкулеза, следовательно, в такой каверне может содержаться примерно 102 клеток, устойчивых к изониазиду. При селективном давлении изониазида (при лечении) устойчивые к этому препарату микобактерии имеют возможность беспрепятственно размножаться. Очевидно, аналогичная ситуация накопления лекарственноустойчивых мутантов M.tuberculosis в организме больного туберкулезом возможна и в случае применения других антимикробных препаратов. Различия заключаются лишь в молекулярных механизмах возникновения устойчивости. Накопленные к настоящему времени данные о природе лекарственной устойчивости M.tuberculosis представлены в табл. 1.
| Таблица 1. Механизмы действия противотуберкулезных препаратов и лекарственной устойчивости к ним M.tuberculosis |
| Антимикробный препарат |
Механизм действия |
Гены, ответственные за устойчивость |
Вероятность встречаемости мутантов, % |
Механизм устойчивости |
| Изониазид |
Ингибирование синтеза миколовой кислоты |
1) katG (каталаза-пероксидаза) |
47-58 |
1) Мутации в гене katG приводят к потере активности интермедиатов изониазида. |
| 2) inhA (енол-АСР-редуктаза) |
21-34 |
2) Суперэкспрессия гена inhA обеспечивает продолжение синтеза миколовой кислоты и вызывает инактивацию активного интермедиата изониазида. |
| 3) ahpC (алкил-гидропероксид-редуктаза) |
10-15 |
3) Мутации в гене ahpC способствуют детоксикации активного интермедиата изониазида |
| Рифампицин |
Ингибирование ДНK-зависимой РНK-полимеразы |
rpoB (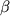 -субъединица РНK-полимеразы) -субъединица РНK-полимеразы) |
96-98 |
Мутации приводят к снижению способности фермента связываться с рифампицином |
| Стрептомицин |
Ингибирование синтеза белка |
1) rpsL (рибосомный белок S12) |
52-59 |
Мутации приводят к изменению структуры рибосом и снижению проницаемости внешних структур микробной клетки |
| 2) rrs (16S рРНK) |
8-21 |
| Этамбутол |
Ингибирование биосинтеза арабиногалактана и липоарабиноманнана |
embAB (арабинозил-трансфераза) |
50 |
Высокий уровень экспрессии или мутация в гене embAB делает возможным продолжение синтеза арабина |
| Пиразинамид |
Не известен |
pcnA |
Не известен |
Потеря активности пиразинамидазы нарушает процесс превращения пиразинамида в пиразиновую кислоту |
| Фторхинолоны |
Ингибирование ДНK-гиразы (топоизомеразы IV) |
gyrA (субъединица А ДНK-гиразы) |
75-94 |
Снижение аффинности фермента к препаратам фторхинолоновой группы |
Устойчивость к изониазиду. M.tuberculosis и M.bovis высокочувствительны к изониазиду. Препарат оказывает подавляющий эффект на клетки этих микроорганизмов в концентрации 0,02 мкг/мл. Остальные виды микобактерий менее чувствительны к изониазиду. Для их подавления требуется концентрация препарата от 1 до 10 мкг/мл. Имеется огромное количество информации, как в области генетики, так и биохимии, о многоступенчатости процесса активации изониазида, превращении его в активное производное, способное ингибировать синтез миколовой кислоты. Клетки M.tuberculosis поглощают изониазид, где происходит его окисление с помощью каталазы-пероксидазы и превращение в активный промежуточный продукт, который оказывает губительное действие на клетку. Долгое время отсутствие каталазной активности рассматривалось только в качестве маркера устойчивости к изониазиду [10, 11]. Недавно установлено, что эта корреляция является результатом мутации в гене katG, кодирующем синтез каталазы-пероксидазы [12, 13]. Это явление наблюдается приблизительно у 50% клинических штаммов (см. табл. 1).
В присутствии интактной каталазы-пероксидазы генерируется активный агент, который подавляет работу фермента, участвующего в синтезе миколовой кислоты - енол-кислой фосфатредуктазы, кодируемой геном inhA [14, 15]. По-видимому, мутации в гене inhA являются причиной устойчивости к изониазиду 25% клинических изолятов. Как правило, эти мутации обусловливают низкий уровень устойчивости к изониазиду (МПК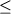 1 мкг/мл) [16]. Большинство мутаций приводят к активации экспрессии гена inhA и, следовательно, к повышению содержания енол-кислой фосфатредуктазы, которая подавляет ингибирующее действие изониазида, участвуя в процессе детоксикации его активного промежуточного продукта [14, 17, 18]. 1 мкг/мл) [16]. Большинство мутаций приводят к активации экспрессии гена inhA и, следовательно, к повышению содержания енол-кислой фосфатредуктазы, которая подавляет ингибирующее действие изониазида, участвуя в процессе детоксикации его активного промежуточного продукта [14, 17, 18].
После идентификации генов katG и inhA стало очевидным, что 10-20% изолятов, устойчивых к изониазиду, не имеют мутаций ни в одном из этих генов. В процессе поиска дополнительных генов был обнаружен ген ahpC, который кодирует алкил-гидропероксид-редуктазу. Этот фермент также участвует в детоксикации активного промежуточного продукта изониазида [11]. У многих бактерий ген ahpC контролируется геном oxyR, который регулирует ответ на окислительный шок. Интересно, что ген oxyR в клетках M.tuberculosis и M.bovis функционально не активен, тогда как в микобактериях других видов его функция не нарушена [19, 20]. По-видимому, в связи с нарушением работы генов oxyR и ahpC в клетках M.tuberculosis не происходит детоксикации промежуточного продукта изониазида, что, в свою очередь, делает микобактерии этого вида более чувствительными к препарату. Это обстоятельство может служить основой для изучения избирательной чувствительности различных видов Mycobacterium туберкулезного комплекса к изониазиду на молекулярном уровне [19]. До сих пор не ясно, в состоянии ли мутации в гене ahрC, идентифицированные приблизительно у 10% изолятов, компенсировать отсутствие гена oxyR [11]. Кроме того, остаются неизвестными механизмы устойчивости к изониазиду примерно у еще 10% клинических изолятов M.tuberculosis.
Устойчивость к рифампицину. Рифампицин является препаратом широкого антибактериального спектра действия, который участвует в синтезе мРНК, связываясь с РНК-полимеразой. Некоторые бактерии, например, Escherichia coli, Neisseria meningitidis, приобретают устойчивость к рифампицину в результате образования мутаций в определенной области 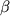 -субъединицы РНК-полимеразы (ген rpoB) [8, 21,22]. Микобактерии не являются исключением. Такие мутации обнаружены более чем у 97% клинических изолятов M.tuberculosis (кодоны от 507 до 533) [22], у устойчивых к рифампицину изолятов M.leprae [23, 24] и M.avium [25]. -субъединицы РНК-полимеразы (ген rpoB) [8, 21,22]. Микобактерии не являются исключением. Такие мутации обнаружены более чем у 97% клинических изолятов M.tuberculosis (кодоны от 507 до 533) [22], у устойчивых к рифампицину изолятов M.leprae [23, 24] и M.avium [25].
Мутации в гене rроB, приводящие к заменам аминокислот в определенных позициях: А->Т/233 (His->Leu), C->G/232 (His->Asp), A->T/203 (Asp->Val), C->T/248 (Ser->Leu), обнаружены у 13% рифампициноустойчивых изолятов (табл.2). Они обеспечивают высокий уровень устойчивости к рифампицину, но низкий - к рифабутину (МПК 0,25-0,5 мкг/мл) [26]. Эти МПК находятся в диапазоне концентраций, обнаруживаемых в сыворотке крови, но которые ниже достигаемых в пораженных тканях [27]. Очевидно, что при выделении у больных Rifr штаммов M.tuberculosis с мутациями в гене rpoB, для лечения можно довольно успешно использовать рифабутин.
| Таблица 2. Мутации, детерминирующие устойчивость клинических штаммов M.tuberculosis к рифампицину (МПК > 50 мкг/мл) |
| N штамма M.tuberculosis |
Фрагмент rpoB, п.о. |
Мутация rpoB |
IS 6110 |
| 31/2 |
431 |
А->Т/233, His->Leu* |
+ |
| 38/2 |
431 |
C->G/232, His->Asp* |
+ |
| 111/2 |
431 |
A->T/203, Asp->Val*
G->A/395, Аrg->Gln** |
+ |
| 14/2 |
431 |
C->T/248, Ser->Leu* |
+ |
| 25/2 |
431 |
C->T/248, Ser->Leu* |
+ |
| 109/3 |
431 |
A->T/203, Asp->Val* |
+ |
| 28/10 |
431 |
C->T/248, Ser->Leu* |
+ |
| 26/10 |
431 |
C->G/232, His->Asp* |
+ |
| 29/7 |
431 |
C->T/248, Ser->Leu* |
+ |
| 125/3 |
431 |
C->T/232, His->Tyr** |
+ |
| 120/3 |
431 |
C->G/232, His->Asp** |
+ |
| 158/6 |
431 |
C->T/248, Ser->Leu* |
+ |
| 153/6 |
431 |
C->G/232, His->Asp* |
+ |
| 44/2 |
431 |
C->T/248, Ser->Leu* |
+ |
| 32/2 |
431 |
A->G/233, His->Arg* |
+ |
| 141/6 |
431 |
C->T/248, Ser->Leu* |
+ |
| 155/6 |
431 |
C->T/248, Ser->Leu* |
+ |
| 41/8 |
431 |
GA->TT/202-203, Asp->Phe** |
+ |
| 147/6 |
431 |
C->T/248, Ser->Leu* |
+ |
| 69/8 |
431 |
A->C/194, Gln->Pro* |
+ |
| 46/8 |
431 |
GA->TT/202-203, Asp->Phe** |
+ |
| 2/7 |
431 |
C->T/221, Ser->Leu** |
+ |
| 4361 |
431 |
G->T/202, Asp->Tyr** |
+ |
| 12/7 |
429 |
A->T/91, Met->Leu** T->C/227,
G->C/228 Leu->Ser** G->A/349,
A->G/350, G->T/351 Glu->Ser**,
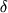 GGG/354 Glu** GGG/354 Glu** |
+ |
| 53/8 |
414 |
D199-207ATGGACCAG Met Asp Gln** |
+ |
Примечание: IS 6110 - специфическая последовательность для клеток семейства микобактерий туберкулезного комплекса.
*Мутации, выявленные Telenti и др. [22].
**Мутации, выявленные Е.А. Панферцевым и др. [21, 28].
Е.А. Панферцевым и др. [21, 28] при изучении молекулярных механизмов устойчивости к рифампицину выделенных на территории Российской Федерации клинических штаммов M.tuberculosis выявлен в области 400 п.о., определенной ранее Telenti и др. [22], ряд дополнительных мутаций, детерминирующих высокий уровень устойчивости (МПК 70 мкг/мл) (см. табл. 2).
Далее...
Написать комментарий
|

