|
М.Е. Додзин, К.А. Виноградова, И.Б. Котова Московский государственный университет им. М.В. Ломоносова.
В начало...
Выделены из почвы и идентифицированы 2 новых штамма-продуцента L-глутаматоксидазы: Streptomyces cremeus шт. 510 и Streptomyces litmocidini шт. 447. С применением метода "математического планирования эксперимента" проведена оптимизация состава ферментационной среды, что позволило увеличить L-глутаматоксидазную активность продуцентов более чем в 5 раз по сравнению с исходной на стандартной среде.Ключевые слова:
Оксидазы L-аминокислот обнаружены в различных природных источниках, в том числе и в микроорганизмах. В частности, из биомассы нескольких видов стрептомицетов выделены и охарактеризованы новые высокоспецифичные ферменты - L-глутаматоксидазы, катализирующие окислительное дезаминирование L-глутаминовой кислоты в 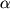 -кетоглутаровую кислоту с образованием NH3 и H2O2 [1, 2]. Практическое значение этих высокоспецифичных оксидаз очевидно: как аналитический инструмент они дали новые возможности для быстрого и высокоточного определения в различных субстратах как L-глутамата, так и ряда других веществ (аммиака, L-глутамина, креатинина, некоторых аминотрансфераз и трансаминаз, NADH и NADPH, сывороточного Mg). -кетоглутаровую кислоту с образованием NH3 и H2O2 [1, 2]. Практическое значение этих высокоспецифичных оксидаз очевидно: как аналитический инструмент они дали новые возможности для быстрого и высокоточного определения в различных субстратах как L-глутамата, так и ряда других веществ (аммиака, L-глутамина, креатинина, некоторых аминотрансфераз и трансаминаз, NADH и NADPH, сывороточного Mg).
Данные свойства, а также удобство производства L-глутаматоксидаз с использованием актиномицетов в качестве продуцентов, способствовали началу широкого применения этих ферментов в медицине, фармакологии, в микробиологической и пищевой промышленности; а также при проведении фундаментальных исследований в области физиологии нервной системы [1-5].
Целью работы являлся поиск актиномицетов - продуцентов L-глутаматоксидаз для получения высокоэффективных источников производства биосенсоров с данными свойствами. Настоящее сообщение посвящено изучению систематического положения выделенных в ходе направленного поиска штаммов-продуцентов этого фермента, а также результатам селекционных и факторных экспериментов по стабилизации и повышению исходной L-глутаматоксидазной активности данных штаммов.
В работе изучали культуры актиномицетов, выделенные из почвенных образцов различных почвенно-климатических зон России, а также полученные из коллекции лаборатории биологически активных веществ кафедры микробиологии МГУ.
Для выделения актиномицетов использовали традиционный метод посева из разведений почвенной суспензии на казеин-глицериновый агар с применением различных приемов, улучшающих условия их выделения (внесение в среду нистатина, хитина и др.) [6]. Родовую и видовую идентификацию выделенных штаммов актиномицетов-продуцентов проводили с изучением общепринятых морфологических, культуральных и хемотаксономических (тип клеточной стенки) показателей на стандартных средах, используя соответствующие руководства [6-12].
Образование L-глутаматоксидаз исследуемыми штаммами проверяли на жидких средах в условиях глубинного культивирования, которое проводили в трех вариантах: 1) посевным материалом служила биомасса, полученная на агаризованной овсяной среде [8], для ферментации использовали среду "П" следующего состава (в %) [1]: растворимый крахмал - 1,50; глюкоза - 1,00; соевая мука - 1,50; сухие дрожжи - 0,50; NaCl - 0,25; CaCO3 - 0,30; K2НPO4 - 0,10; pH 7,6;
2) посевной материал тот же; в качестве ферментационной использовали среду "Ф" следующего состава (в %) [1]: растворимый крахмал - 1,50; полипептон - 1,00; KСl - 0,05; MgSO4x7H2O - 0,05; K2HPO4 - 0,10; pH 7,6;
3) посевным материалом служила 2-суточная биомасса, выращенная в условиях глубинного культивирования в среде "П"; ее переносили в колбы со средой "Ф" в количестве 5% объема среды и культивировали в тех же условиях.
Культивирование продуцентов проводили в колбах Эрленмейера вместимостью 750 мл (100 мл среды) на круговых качалках (200 об/мин, 28?С). Активность стрептомицетов определяли в динамике, на 3-7 сутки роста культур, микромоноспор - на 30-36 сутки роста.
L-глутаматоксидазную активность актиномицетов определяли в культуральной жидкости после отделения мицелия центрифугированием (8000 об/мин, 10 мин). В основе спектрофотометрического метода лежит измерение количества Н2О2, образующейся при окислении L-глутаминовой кислоты. Перекись водорода, соединяясь с хромогенным донором водорода ("фотоглюкоза" фирмы "Импакт") в присутствии пероксидазы, образует окрашенное вещество, наличие которого регистрировали на спектрофотометре СФ-26 при 500 нм, l - 1 см. За единицу L-глутаматоксидазной активности принимается то количество фермента, которое катализирует образование 1 мкмоля перекиси водорода в минуту. Расчет активности продуцента на 1 мл культуральной жидкости вели по формуле:
N А (ед. активности/мл) = (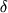 OD*N) / (6,0* OD*N) / (6,0*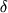 t), t),
где 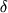 OD - изменение оптической плотности за промежуток времени OD - изменение оптической плотности за промежуток времени 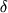 t; t; N - разведение культуральной жидкости.
В качестве одного из методов повышения L-глутаматоксидазной активности выделенных штаммов-продуцентов использовали качественный метод быстрого отбора активных колоний на плотной среде, также основанный на цветной реакции, фиксирующей наличие фермента. Чашки с плотной средой, на которых в результате рассева исходной популяции выросли отдельные колонии, заливали той же реакционной смесью (с добавлением агара), что использовалась при спектрофотометрии. Примерно через сутки вокруг колоний, способных синтезировать фермент, развивается отчетливая розовая окраска верхнего слоя агара. Такие колонии отсевали на косяки с овсяным агаром и изучали в дальнейших экспериментах.
Оптимизацию состава ферментационной питательной среды проводили с применением метода математического планирования эксперимента [13] в два этапа: построение адекватной математической модели процесса; нахождение собственно оптимального состава среды одним из известных способов.
Для получения простейшей адекватной модели требовалось связать выходной параметр системы (L-глутаматоксидазная активность) с входными - концентрациями компонентов ферментационной среды. В эксперименте единовременно проверяли серию вариантов ферментационных сред, в которых все компоненты (факторы) варьировались на двух количественных уровнях ("верхнем" и "нижнем"). Таким образом, число вариантов так называемого "полного факторного эксперимента" (ПФЭ) соответствовало числу всех возможных сочетаний варьируемых компонентов среды. Для n факторов, каждый из которых был взят на 2-х уровнях концентрации, число вариантов состава сред - 2n. Такой факторный эксперимент обозначается как ПФЭ-2n.
После соответствующей математической обработки экспериментальных данных, зависимость L-глутаматоксидазной активности Y штамма от концентрации в среде всех варьируемых компонентов представляется в виде многофакторного уравнения регрессии, являющегося по сути искомой математической моделью процесса:
Y = b0 + b1X1 + b2X2 + ... + bnXn, где
Xn - содержание соответствующего компонента в среде в условных единицах ("+1" - верхний уровень, "-1" - нижний уровень); Y - активность штамма (ед/мл среды); bn - коэффициенты регрессии, отражающие степень влияния концентрации в среде n-го фактора на L-глутаматоксидазную активность Y. Для их расчета использовалась формула Йейтса:
bn = (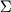 XnYn) / N, где XnYn) / N, где
Xn = 1 - значение фактора в соответствующем варианте факторного эксперимента;
Yn - величина активности штамма в соответствующем варианте;
N - общее число вариантов в ПФЭ.
Следующий этап - определение оптимального состава ферментационной среды в эксперименте по схеме "крутого восхождения", в вариантах которого последовательно, с определенным шагом 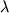 *, изменяли концентрации компонентов в среде. Основой для расчета *, изменяли концентрации компонентов в среде. Основой для расчета 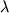 * являются величины bn. В серии вариантов одновременно увеличивали или уменьшали дозы тех факторов, коэффициенты регрессии при которых имели соответсвенно знаки "+" или "-". * являются величины bn. В серии вариантов одновременно увеличивали или уменьшали дозы тех факторов, коэффициенты регрессии при которых имели соответсвенно знаки "+" или "-".
Далее...
Написать комментарий
|

