Следующий раздел: 2. Химия в природе
Выше по контексту: Проект Краткая Энциклопедия. Химия ...
Предыдущий раздел: Проект Краткая Энциклопедия. Химия ...
Алфавитный индекс
Разделы
Вопрос: Как Авогадро открыл число 6*1023 ?
Ответ: В 1814 г. Авогадро сделал утверждение: равные объемы газообразных
веществ при
одинаковых давлении и температуре содержат одно и то же число молекул.
В 1865 г. Лошмидт рассчитал
число молекул, содержащихся при нормальных условиях в 1 см3 - около
1021.
В начале 20 века, объясняя
голубой цвет неба, Бриллюэн получил количество молекул в
моле равным 6*1023.
В 1901 г. Планк , объясняя излучение черного тела, получил
NA = 6,16*1023.
В 1908 г. Резерфорд
и Гейгер , опираясь на число Фарадея,
получили NA = 6,2*1023.
В 1908 г. Перрен , объясняя
броуновское движение, получил NA = 6,85*1023.
Самый точный метод на
сегодня - дифракция рентгеновских лучей - дает
NA = 6,0221367*1023.
Литература: М.Льоцци
"История физики", М., "Мир", 1970, стр. 343-351.
(c) Дистанционный консультационный пункт
distant@ssl.nsu.ru
Вопрос: Каким
способом можно рассчитать средний промежуток времени между 2-мя столкновениями
молекул в газообразном атомарном водороде, если скорость движения атомов
неизвестна? Известны: радиус атома водорода, температура, длина свободного
пробега между 2-мя столкновениями.
Ответ: Оценим
время между столкновениями по порядку величины. Характерная скорость v
частицы газа (в данном случае атома водорода) такова, что ее кинетическая
энергия порядка kT, где k = 1.38*10-23 Дж/К -
постоянная Больцмана, а T - температура газа. Таким образом,
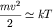 или или
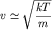 .
Здесь m - масса частицы.
Для характерного времени t
между столкновениями одной частицы с
остальными по порядку величины имеем: .
Здесь m - масса частицы.
Для характерного времени t
между столкновениями одной частицы с
остальными по порядку величины имеем:
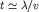 ,
где ,
где 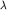 - длина свободного пробега молекулы.
Если нас интересует
время между любыми столкновениями молекул в газе tN
(N -
полное число частиц в газе), то за время t
происходит N/2 столкновений
(коэффициент 1/2 возникает из-за того, что соударение частицы под номером
i с частицей j и соударение j
с i - одно и
то же соударение). Поскольку столкновения происходят случайно, то - длина свободного пробега молекулы.
Если нас интересует
время между любыми столкновениями молекул в газе tN
(N -
полное число частиц в газе), то за время t
происходит N/2 столкновений
(коэффициент 1/2 возникает из-за того, что соударение частицы под номером
i с частицей j и соударение j
с i - одно и
то же соударение). Поскольку столкновения происходят случайно, то
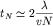 . .
В более аккуратной
модели, учитывающей распределение молекул газа по скоростям, можно получить:
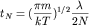 . .
Видно, что этот конечный
ответ отличается от предварительной оценки на коэффициент порядка единицы,
который достаточно условен (он зависит от точного определения понятия длины
свободного пробега).
Литература: Д.В.Сивухин "Общий
курс физики", том 2, М., Наука, 1990, параграф 86.
(c) Дистанционный консультационный пункт
distant@ssl.nsu.ru
Вопрос: Выполняется ли закон Дальтона для реальных газов?
Ответ: Законы Дальтона звучат следующим образом:
- давление смеси химически не взаимодействующих
идеальных газов равно сумме парциальных давлений,
- при постоянной температуре растворимость в данной
жидкости каждого из компонентов газовой
смеси, находящейся над жидкостью, пропорционально его
парциальному давлению.
Оба закона Дальтона строго выполняются для идеальных газов.
Для реальных газов эти законы применимы
при условии, если их растворимость невелика, а поведение
близко к поведению идеального газа.
Теоретическое нахождение давления смеси реальных газов является очень трудной задачей. Рассмотрим
частный случай смеси неплотных неидеальных газов. Как известно, для таких газов уравнением состояния
является уравнение Ван-дер-Ваальса:
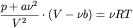 или
или
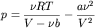 ,
где ,
где 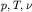 - давление, температура и количество молей газа,
соответственно, R - универсальная газовая постоянная,
a и b - константы, характеризующие силы
притяжения и отталкивания между молекулами газа.
Для неплотных газов, когда - давление, температура и количество молей газа,
соответственно, R - универсальная газовая постоянная,
a и b - константы, характеризующие силы
притяжения и отталкивания между молекулами газа.
Для неплотных газов, когда 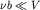 ,
можно записать вириальное разложение: ,
можно записать вириальное разложение:
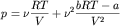 .
Видно, что давление реального газа отличается от давления
идеального на величину, пропорциональную bRT-a ,
которая может быть как больше, так и меньше нуля
(все определяется тем, какие силы между молекулами преобладают
- отталкивания или притяжения). Допустим, мы смешиваем два
неплотных реальных газа, у которых константы a
и b идентичны (например, изотопы). Тогда: .
Видно, что давление реального газа отличается от давления
идеального на величину, пропорциональную bRT-a ,
которая может быть как больше, так и меньше нуля
(все определяется тем, какие силы между молекулами преобладают
- отталкивания или притяжения). Допустим, мы смешиваем два
неплотных реальных газа, у которых константы a
и b идентичны (например, изотопы). Тогда:
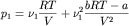 , ,
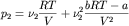 , ,
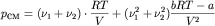 ,
где p1, p2,
pCM - давление первого газа,
второго газа и их смеси соответственно. ,
где p1, p2,
pCM - давление первого газа,
второго газа и их смеси соответственно.
Легко получить, что
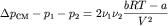 .
Таким образом, при .
Таким образом, при
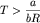 давление смеси газов будет
больше суммы парциальных давлений, при
давление смеси газов будет
больше суммы парциальных давлений, при
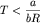 давление смеси газов будет меньше суммы
парциальных давлений, а при
давление смеси газов будет меньше суммы
парциальных давлений, а при
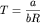 закон Дальтона будет выполняться. закон Дальтона будет выполняться.
Литература:
Р.В.Телеснин "Молекулярная физика", М., 1973,
Д.В.Сивухин "Общий курс физики", том 2, М., Наука, 1990, глава 8,
Я.М.Гельфер, В.Л.Любошиц, М.И.Подгорецкий "Парадокс Гиббса
и тождественность частиц в квантовой механике", М., Наука, 1975, глава 4.
(c) Дистанционный консультационный пункт
distant@ssl.nsu.ru
Вопрос: Как выглядит F-облако?
Ответ: Вероятность
нахождения электрона в атоме определяется несколькими целыми числами -
n, l, m.
n - главное квантовое
число, характеризующее значение энергии
стационарных состояний атома, причем n = 1, 2, ...
l - орбитальное квантовое число, характеризующее орбитальный
момент количества движения
электрона, причем l = 0, 1, ...
Для состояний с различными принята система буквенных обозначений:
| l = |
тип орбитали |
| 0 |
s |
| 1 |
p |
| 2 |
d |
| 3 |
f |
| 4 |
g |
| ... |
... |
m - магнитное
квантовое число, характеризующее проекцию орбитального момента количества
движения электрона на выбранную ось, причем
m = -l, -l+1, -l+2, ... , l-1, l.
При заданных числах n, l, и m
среднее распределение
электронного заряда задается
формой электронного облака. На рисунке 1 показана зависимость распределения
от углов электронной плотности в электронном облаке атома водорода
для
состояний с l = 3
(f-облако).
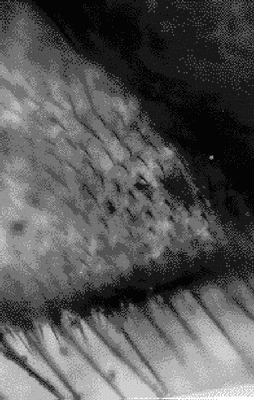 |
| Рис. 1.F-облако |
Источник:
Энциклопедия "Физика микромира", М., 1980, статья "Атом",
S.Brandt, H.D.Dahmen
"Mechanika kwantowa w obrazach", Warszawa, 1989, стр.151, 209-211.
(c) Дистанционный консультационный пункт
distant@ssl.nsu.ru
E.M.Baldin@inp.nsk.su
23 Января 2000
Следующий раздел: 2. Химия в природе
Выше по контексту: Проект Краткая Энциклопедия. Химия ...
Предыдущий раздел: Проект Краткая Энциклопедия. Химия ...
Алфавитный индекс
Написать комментарий
|

