|
А.М. Запрудов
Открытие антибактериальной эры породило надежды врачей на быстрые успехи в лечении многих инфекционных заболеваний как у взрослых, так и у детей. Однако довольно скоро выяснилось, что многие микроорганизмы обладают выживаемостью при воздействии антибактериальных препаратов при полной чувствительности к этому лекарственному средству. Более того, при терапевтической концентрации этих веществ микроорганизмы способны к размножению. Выделяют устойчивость природную, в том числе видовую, и приобретенную - первичную, вторичную и передаваемую экстрахромосомально [1].
Причины природной устойчивости разнообразны. Одна из них - наличие у микроорганизмов специфических ферментов, которые расщепляют молекулу антибактериального препарата. С другой стороны, препарат не может действовать, поскольку у микроорганизма отсутствуют структуры (рецепторы), чувствительные к влиянию антибиотика.
Первичная приобретенная устойчивость микроорганизмов имеет место в тех случаях, когда она определяется до начала антибиотикотерапии. Вторичная устойчивость микроорганизма, как правило, развивается при бесконтрольном применении антибиотиков, особенно в малых дозах. Внехромосомальная устойчивость возникает в результате появления у микроорганизмов плазмид и эписом, несущих генетическую информацию. Этот тип свойствен грамотрицательным бактериям. Несмотря на определенную условность такой градации установление причины микробной устойчивости к антибактериальным препаратам в клинических условиях имеет первостепенное значение.
Среди ферментов, обусловливающих устойчивость микроорганизмов к антибиотикам, особое внимание приковывают к себе  -лактамазы. Появление и широкое распространение микроорганизмов, способных продуцировать -лактамазы. Появление и широкое распространение микроорганизмов, способных продуцировать  -лактамазу, привело к тому, что последние 20 лет лечение инфекционных заболеваний, вызванных как обычными энтеробактериями, так и стафилококками, стало представлять сложную терапевтическую задачу [2]. -лактамазу, привело к тому, что последние 20 лет лечение инфекционных заболеваний, вызванных как обычными энтеробактериями, так и стафилококками, стало представлять сложную терапевтическую задачу [2].
b-Лактамазы продуцируются большим количеством грамположительных бактерий, аэробными и анаэробными грамотрицательными бактериями, мико-бактериями. С клинической точки зрения, это самый важный механизм развития бактериальной резистентности к пенициллинам и цефалоспоринам. Весьма существенно, что  -лактамазу могут продуцировать микроорганизмы, которые находятся в очаге инфекции, но не являются причиной заболевания. Все это вместе взятое обусловливает инактивацию пенициллина и его аналогов, хотя основные патогены могут и не продуцировать -лактамазу могут продуцировать микроорганизмы, которые находятся в очаге инфекции, но не являются причиной заболевания. Все это вместе взятое обусловливает инактивацию пенициллина и его аналогов, хотя основные патогены могут и не продуцировать  -лактамазу [3]. -лактамазу [3].
Настораживает, что за последние годы появилась тенденция к преобладанию штаммов и видов микроорганизма, способных продуцировать  -лактамазу.Например, в Великобритании резистентность штаммов E. coli к ампициллину/амоксициллину у больных возросла с 24% в 1981 г. до 39% в 1992 г. [4]. Аналогичные данные имеются по другим странам и континентам. У жителей Северной Америки резистентность штаммов H. influenzae, обусловленная выработкой -лактамазу.Например, в Великобритании резистентность штаммов E. coli к ампициллину/амоксициллину у больных возросла с 24% в 1981 г. до 39% в 1992 г. [4]. Аналогичные данные имеются по другим странам и континентам. У жителей Северной Америки резистентность штаммов H. influenzae, обусловленная выработкой  -лактамаз, возросла с 15% в 1983-1984 гг. до 36% в 1994-1995 гг. [5]. В Европе количество штаммов M. catarhalis, продуцирующих -лактамаз, возросла с 15% в 1983-1984 гг. до 36% в 1994-1995 гг. [5]. В Европе количество штаммов M. catarhalis, продуцирующих  -лактамазу, увеличилосьс 40% в 1981 г. до 60-90% в 1991 г. [6, 7]. -лактамазу, увеличилосьс 40% в 1981 г. до 60-90% в 1991 г. [6, 7].
Наличие  -лактамаз у микроорганизмов, таким образом, обеспечило их устойчивость к антибиотикам, но с другой стороны, снизило терапевтическую активность последних. Особенно это касается группы полусинтетических пенициллинов - производных 6-аминопенициллиновой кислоты. Наиболее известными и хорошо зарекомендовавшими себя в клиническом плане являются ампициллин и амоксициллин, обладающие широким спектром действия, высокой эффективностью, хорошей всасываемостью в кишечнике при пероральном введении. То обстоятельство, что эти антибактериальные препараты являются высокоактивными в отношении стрептококков, пневмококков, H. Influenzae и M. catarrhalis, обусловило поиск ингибиторов -лактамаз у микроорганизмов, таким образом, обеспечило их устойчивость к антибиотикам, но с другой стороны, снизило терапевтическую активность последних. Особенно это касается группы полусинтетических пенициллинов - производных 6-аминопенициллиновой кислоты. Наиболее известными и хорошо зарекомендовавшими себя в клиническом плане являются ампициллин и амоксициллин, обладающие широким спектром действия, высокой эффективностью, хорошей всасываемостью в кишечнике при пероральном введении. То обстоятельство, что эти антибактериальные препараты являются высокоактивными в отношении стрептококков, пневмококков, H. Influenzae и M. catarrhalis, обусловило поиск ингибиторов  -лактамаз. -лактамаз.
В начале 70-х годов в исследовательских лабораториях фирмы <Смит Кляйн Бичем> была открыта клавулановая кислота - ингибитор  -лактамаз. Комбинированный препарат клавулановая кислота + амоксициллин получил название аугментин. Выбор амоксициллина связан с тем, что, обладая такими же свойствами, как ампициллин, антибиотик значительно лучше всасывается при пероральном введении. Клавуланат, или клавулановая кислота необратимо инактивирует ферменты группы -лактамаз. Комбинированный препарат клавулановая кислота + амоксициллин получил название аугментин. Выбор амоксициллина связан с тем, что, обладая такими же свойствами, как ампициллин, антибиотик значительно лучше всасывается при пероральном введении. Клавуланат, или клавулановая кислота необратимо инактивирует ферменты группы  -лактамаз, позволяя второму компоненту, амоксициллину, проникать в бактериальную клетку, а затем разрушать ее (см. рисунок 1). -лактамаз, позволяя второму компоненту, амоксициллину, проникать в бактериальную клетку, а затем разрушать ее (см. рисунок 1).
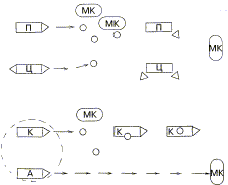 |
Рисунок 1. Преодоление действия  -лактамаз. Присоединение клавуланата инактивирует -лактамаз. Присоединение клавуланата инактивирует  -лактамазы. Амоксициллин разрушает бактериальную клетку. О - -лактамазы. Амоксициллин разрушает бактериальную клетку. О - -лактамаза, П - пенициллин, Ц - цефалоспорин, К - клавулановая кислота, А - амоксициллин, МК - микроорганизм. -лактамаза, П - пенициллин, Ц - цефалоспорин, К - клавулановая кислота, А - амоксициллин, МК - микроорганизм. |
Противомикробная активность. Аугментин является антибиотиком широкого спектра действия. Как бактериолитик он активен в отношении грамположительных и грамотрицательных микроорганизмов, включая штаммы, продуцирующие  -лактамазу (табл. 1). -лактамазу (табл. 1).
| Таблица 1. Противомикробная активность аугментина* |
| Микроорганизмы |
| Грамположительные |
Грамотрицательные |
| аэробы |
анаэробы |
аэробы |
анаэробы |
| Staphylococcus aureus**, Staphylococcus epidermis**, Streptococcus pyogenus, Streptococcus pneumoniac, Streptococcus faecalis, Listeria monocytogenes |
Clostridium species, Peptococcus species |
Escherichia coli**, Proteus mirabilis**, Proteus vulgaris**, Klabsiella specias**, Salmonella specias**, Shigella specias**, Bordetella pertussis, Yersenia enterocolitica**, Neisseria meningitiolis, Neisseria gonorrhoeae**, Branhamella catarrhalis, Haemophilus influenzae**, Campylobacter jejuni |
Bacteroides species, Bacteroides fragilis** |
Примечание. * - по данным P. Ball, A. Geddes, G. Rolinson. Amoxycillin Clavulanate and Assessment after 15 Years of Clinical Application. J of Chemother 1997; 9: 3: 167-198. ** - включая штаммы, продуцирующие  -лактамазу. -лактамазу. |
Входящая в состав аугментина клавулановая кислота обеспечивает устойчивость амоксициллина к воздействию  -лактамаз и расширяет спектр действия препарата. -лактамаз и расширяет спектр действия препарата.
Фармакокинетические свойства амоксициллина и клавулановой кислоты во многих отношениях схожи [2].
При пероральном приеме препарата максимальные концентрации амоксициллина и клавулановой кислоты практически являются одинаковыми (табл. 2). Однако при внутривенном введении в крови создаются значительно бульшие концентрации амоксициллина по сравнению с клавулановой кислотой. Компоненты аугментина по своим фармакокинетическим свойствам очень близки. Это касается биодоступности, времени полувыведения, связывания с белками и т.п. Прием препарата во время еды мало влияет на всасывание компонентов аугментина.
| Таблица 2. Фармакокинетические свойства компонентов, входящих в состав аугментина* |
| Параметр |
Амоксициллин |
Клавулановая кислота |
| Максимальная концентрация в сыворотке крови, мг/л |
пероральный прием |
125 мг |
2,7 |
2,1-3,4 |
| 250 мг |
3,5-5,2 |
4,2-6,0 |
| 500 мг |
6,0-10,8 |
11,0 |
| 1000 мг |
11,6-20,6 |
19,0 |
| внутривенное введение |
100 мг (быстрое введение, 2 мин) |
11,2 |
5,0 |
| 200 мг (быстрое введение, 2 мин) |
20,1 |
5,0 |
| 200 мг (инфузия, 30 мин) |
14,3 |
5,0 |
| Биодоступность(per os, %) |
70-80 |
60-75 |
| Время полувыведения, ч |
0,97-1,1 |
0,9-1,2 |
| Связывание с белками, % |
17 |
22 |
| Общий клиренс, мг/мин |
237 |
215-250 |
| 24-часовое выведение с мочой, % от введенной дозы |
58-70 |
19-43 (per os), 27-58 внутривенно |
| Примечание. * - по данным P. Ball, A. Geddes, G. Rolinson. Amoxycillin Clavulanate and Assessment after 15 Years of Clinical Application. J of Chemother 1997; 9: 3: 167-198. |
Далее...
Написать комментарий
|

