Нобелевская премия по химии за 1999 г. присуждена А.Зевейлу за "изучение переходных состояний химических реакций с помощью фемтосекундной спектроскопии".
Ахмед Зевейл (Ahmed H.Zewail) родился 26 февраля 1946 г. в Египте, учился в Александрийском университете и после его окончания перебрался в США, где в 1974 г. защитил кандидатскую диссертацию в Пенсильванском университете. В 1976 г. он появился в Калтехе, через два года получил там постоянное место и в 1982 г. стал профессором. Сейчас он профессор химии и физики Калифорнийского технологического института.
 | | Рис.1.А. Зевейл. |
Имя нового нобелевского лауреата пользуется большим международным признанием. Зевейл -почетный профессор ряда американских и европейских университетов, член Национальной академии наук США и многих академий других стран; имеет множество наград, медалей и премий. На своей исторической родине - в Египте - Зевейл награжден орденом "За заслуги" I степени, здесь его чтут как национального героя, в 1998 г. с его портретами выпущены почтовые марки.
Часть 1
В основе всех химических реакций лежат элементарные превращения, которые заключаются в разрыве старых или образовании новых химических связей. Во всех элементарных реакциях между реагентами и продуктами существует некое промежуточное образование - так называемое переходное состояние, или переходный (активированный) комплекс, в котором некоторые связи ослаблены (а некоторые могут быть усилены) по сравнению с реагентами.
Изучением элементарных реакций занимается специальный раздел химии - химическая динамика, основная задача которой - определить структуру переходного состояния и проследить динамику его образования и распада в реальном масштабе времени. Это все равно, что заснять химическую реакцию на кинопленку. Каждый кадр на ней - это определенная конфигурация ядер. Особый интерес для химической динамики представляют те "кадры", которые содержат информацию о наиболее активных конфигурациях, т.е. о переходном комплексе. Но для полного описания химической реакции важна вся пленка - весь процесс перехода от реагентов к продуктам.
Основная трудность в изучении элементарных химических реакций - в их невероятной быстроте. Поскольку происходят они главным образом за счет колебаний ядер около положения равновесия в молекуле (двигаются они очень быстро: так, за одну секунду в молекуле иода I2 происходит около 1013 колебаний ядер), то, чтобы разорвать химическую связь, ее нужно сначала "раскачать", т.е. возбудить определенное колебание. Самые быстрые из элементарных реакций, для которых достаточно одного колебания, могут происходить за время 10-14 с. Существуют и более медленные реакции, в которых сначала возбуждается одно колебание, затем возбуждение постепенно передается другому колебанию и наконец разрывается связь. Такие элементарные реакции могут продолжаться довольно "долго":
~10-11с.
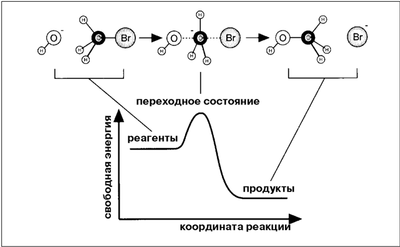 | | Рис.2. Элементарная реакция щелочного гидролиза метилбромида. |
Столь малые промежутки времени измеряются фемтосекундами (фс): 1 фс = 10-15с. В таком масштабе время протекания элементарных реакций составляет 10 104 фс. Реакции в нижней части этого диапазона считают быстрыми, в верхней - "медленными". 104 фс. Реакции в нижней части этого диапазона считают быстрыми, в верхней - "медленными".
Так, например, реакция фотодиссоциации иодциана
ICN + h I + CN I + CN
происходит за 200 фс, фотодиссоциация циклобутана
C4H8 + h 2C2H4 2C2H4
длится около 700 фс, бимолекулярная реакция
H + CO2  OH + CO OH + CO
проходит за 1000 фс, а диссоциация тетрафтордииодэтана на тетрафторэтилен и два атома иода
C2F4I2 + h C2F4 + 2I C2F4 + 2I
имеет два временных масштаба: первый атом иода отщепляется быстро, за 200 фс, а второй - за время, в 100 раз большее. Все эти результаты получены Зевейлом.
Для изучения столь быстрых процессов необходимо иметь измерительное устройство с соответствующим временным разрешением. Это напоминает съемку быстро движущегося объекта: устанавливается настолько малое время экспозиции, что объект кажется неподвижным, иначе изображение будет размазанным, причем тем сильнее, чем больше время экспозиции (вспомните фотографии ночной Москвы, на которых фары движущихся машин оставляют следы в виде сплошных ярких линий). То же самое справедливо для химической реакции: время измерения положения ядер должно быть столь мало, чтобы их движение оказалось как бы замороженным.
Возможность осуществлять эксперименты фемтосекундной длительности появилась только в конце 80-х годов, когда был изобретен способ временного сжатия лазерных световых импульсов до 6 фс (рекорд на конец 1998 г. составляет 4 фс). А до этого структуру переходных состояний и динамику элементарных реакций определяли косвенными методами.
Экспериментальные косвенные измерения основаны на следующей идее: если известны состояния молекул (или атомов) до и после реакции, то, сравнивая их, иногда удается сделать выводы о времени жизни и структуре переходного состояния. Например, если создать пучок молекул CH3I, ориентированных в одном направлении, и подействовать на них поляризованным лазерным излучением, то связь C-I разорвется и произойдет реакция мономолекулярного распада:
CH3I + h [CH3???I]* [CH3???I]*  CH3 + I CH3 + I
(квадратные скобки обозначают переходное состояние). Если молекула распадается быстро (по сравнению с ее вращением), все атомы иода после реакции будут двигаться в одном направлении, поскольку за время реакции исходная молекула не успеет повернуться. Но при медленном распаде атомы иода за счет вращения молекулы будут разлетаться во все стороны. Это похоже на стрельбу из автомата с вращающейся платформы: если очередь короткая, все пули (т.е. атомы иода) полетят почти в одном направлении, а если длинная - то веером. Оказывается, все атомы иода, образующиеся в реакции мономолекулярного распада, двигаются примерно в одном направлении. Это означает, что распад возбужденной молекулы происходит намного быстрее, чем ее вращение, т.е. время жизни переходного состояния не превышает 1000 фс.
Назад | Вперед
Написать комментарий
|

