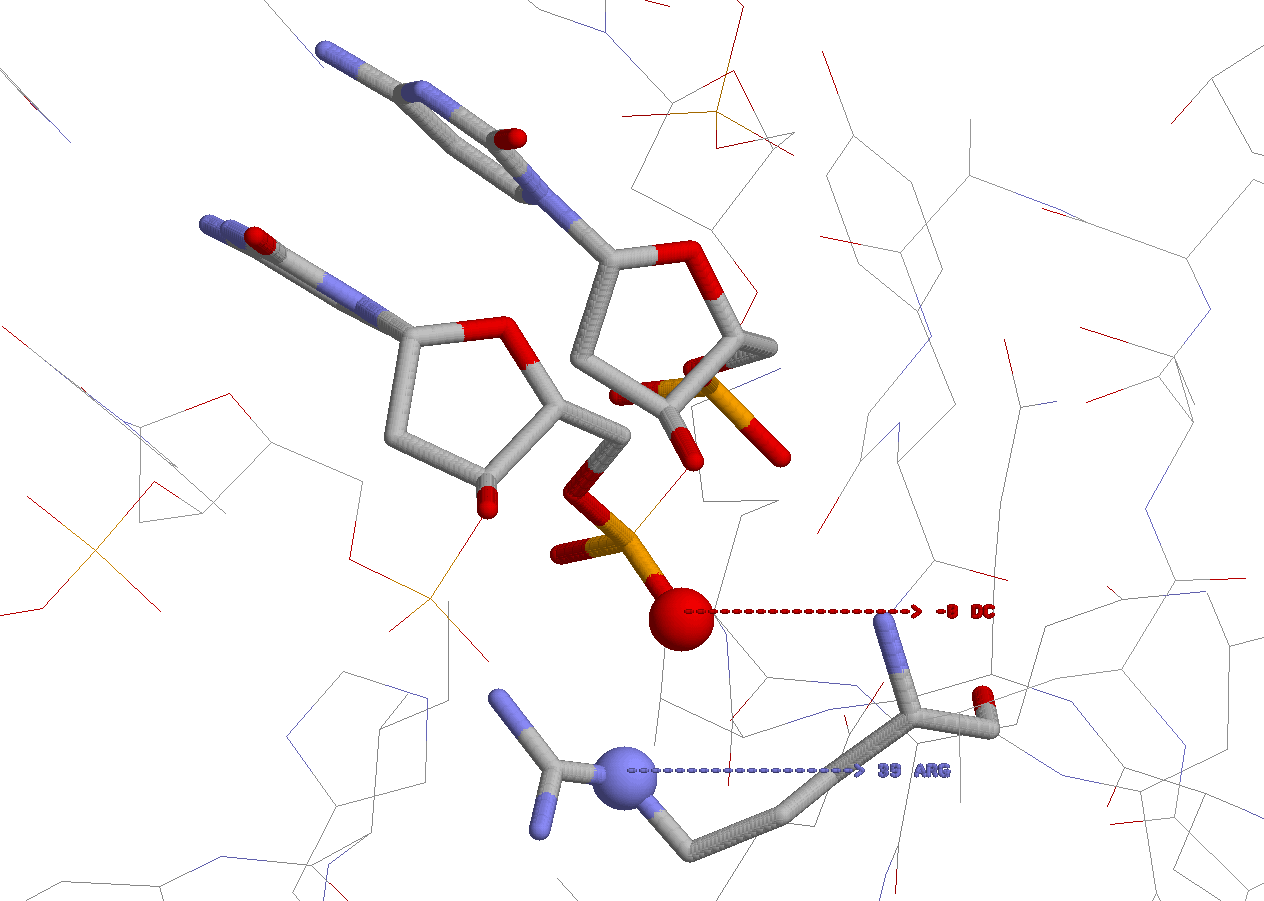
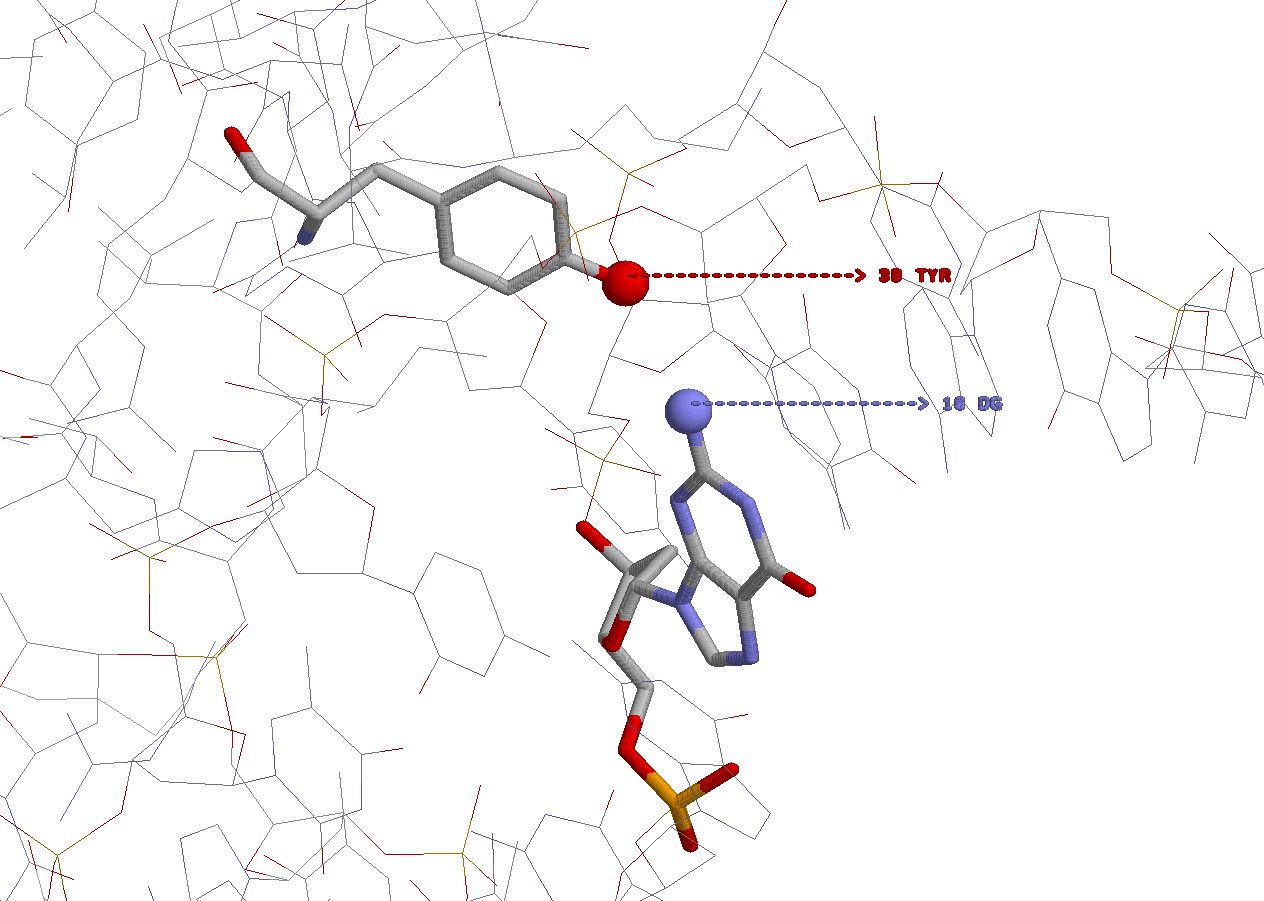
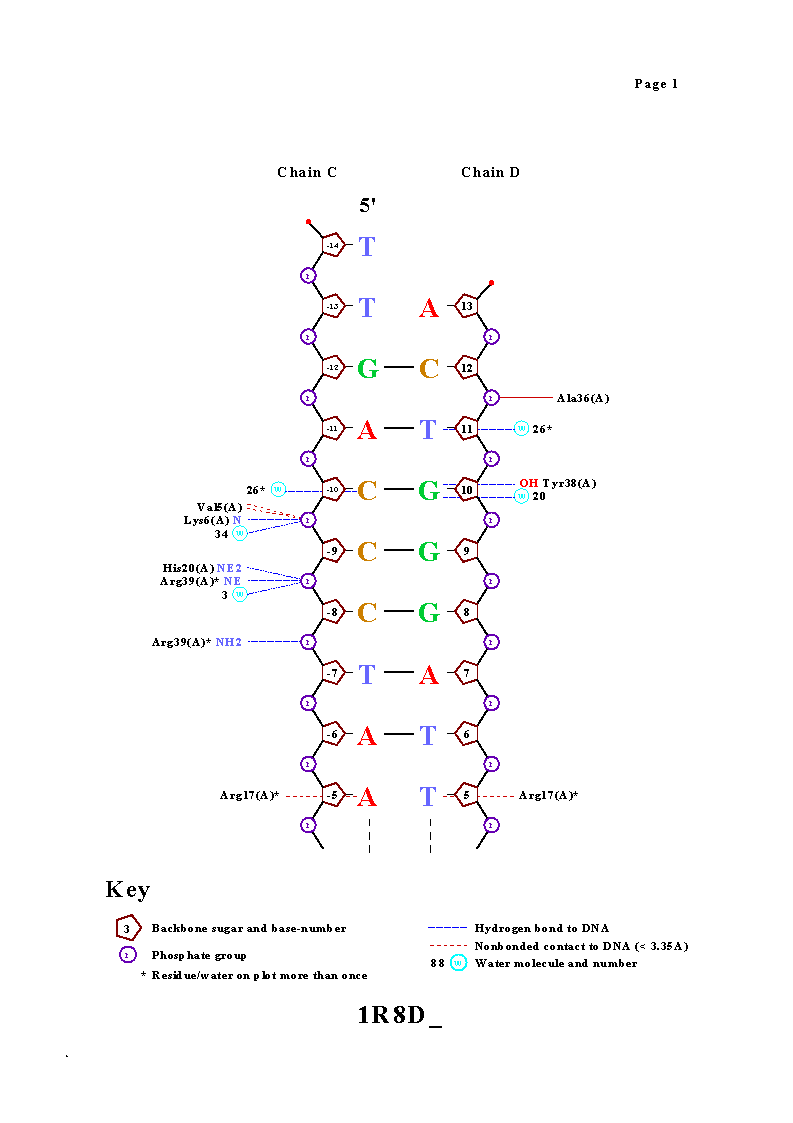
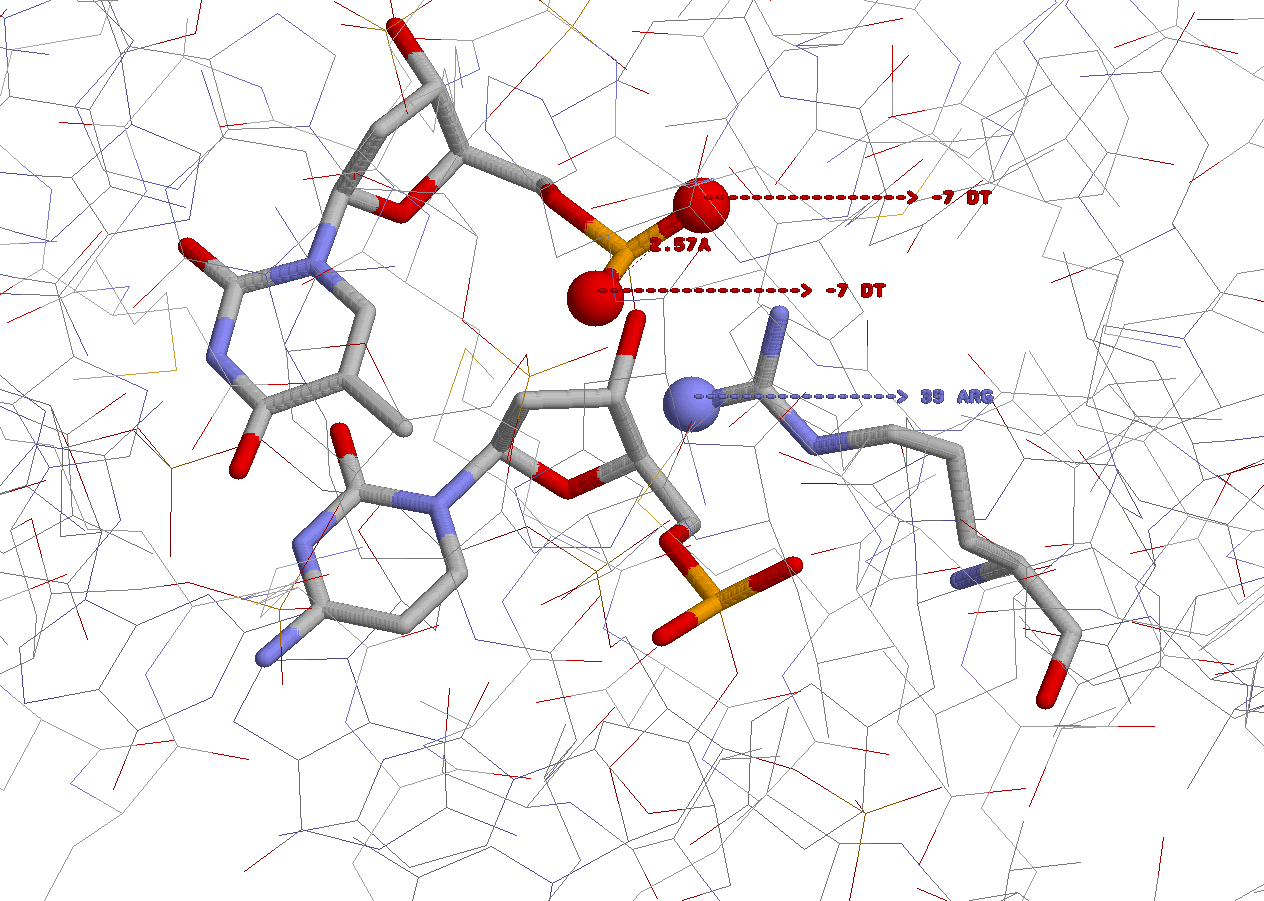
Изображение построено с помощью программы RasMol, структуры ДНК и белка изображены в модели wireframe, раскраска cpk. Взаимодействующие основание и аминокислотный остаток - в модели wireframe40. Все, что взаимодействует, подписано.
|
Документ взят из кэша поисковой машины. Адрес
оригинального документа
: http://kodomo.cmm.msu.ru/~pouliakhina/term3/task_9.html
Дата изменения: Thu Dec 20 15:53:35 2007 Дата индексирования: Tue Oct 2 12:17:03 2012 Кодировка: Windows-1251 |

| Полярные | Гидрофобные | Всего | |
| Контакты белка с ... | |||
| ... остатками 2'-дезоксирибозы | 4 | 42 | 46 |
| ... остатками фосфорной кислоты | 21 | 33 | 54 |
| ... остатками азотистых оснований со стороны большой бороздки | 4 | 8 | 11 |
| ... остатками азотистых оснований со стороны малой бороздки | 2 | 0 | 2 |