|
|
Пивоваров Сергей Анатольевич
Автореферат диссертации на соискание ученой степени кандидата химических
наук |
содержание >> |
Традиционной характеристикой
природных осадков и почв является содержание глинистой (илистой) фракции, которое
обычно определяется путем седиментационного анализа. Содержание алюминия
в глинистой фракции составляет приблизительно 20 вес. %, поэтому количество
глинистого материала в осадке можно оценить, умножив содержание алюминия в 5
раз. Удельная поверхность глинистой фракции составляет, в среднем, 70 м2/г.Наиболее часто в почвах и природных осадках встречаются такие слоистые
силикаты, как каолинит, иллит и монтмориллонит.
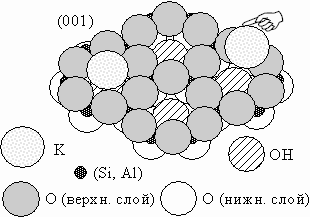 |
| Рис. 8. Структура поверхности мусковита |
Структура поверхности глинистых минералов довольно однообразна, и может быть рассмотрена
на примере мусковита (рис. 8). Поверхность его пакета имеет лунки (адсорбционные
центры). В межпакетном пространстве все лункиоказываются занятыми, тогда как при
отделении пакетов друг от друга ионы калия поровну распределяются между поверхностью
"верхнего" и "нижнего" пакетов. Поэтому на поверхности мусковита
только половина лунок занята ионами калия. Общее количество лунок на поверхности
мусковита составляет 7.08 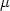 моль/м2, а поверхностная емкость обмена
- 3.54 моль/м2, а поверхностная емкость обмена
- 3.54 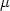 экв/м2. На дне каждой лунки находится гидроксильная группа,
координированная двумя атомами алюминия, >Al2OH. Глинистые минералы
имеют приблизительно такое же строение поверхности, однако поверхностный заряд
решетки меньше, и лежит в пределах 1-3 экв/м2. На дне каждой лунки находится гидроксильная группа,
координированная двумя атомами алюминия, >Al2OH. Глинистые минералы
имеют приблизительно такое же строение поверхности, однако поверхностный заряд
решетки меньше, и лежит в пределах 1-3 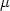 экв/м2. экв/м2.
Своеобразие глинистых минералов определяется ионным обменом.
Заряд поверхности глинистого минерала, в отличие от оксида, более или менее
фиксирован. Поэтому стехиометрические соотношения при обмене противоионов в
данном случае проявлены в явном виде.
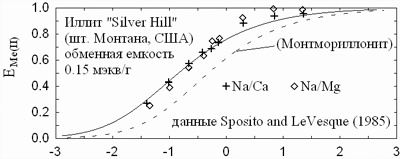
На рис. 9 показаны кривые замещения натрия в обменной емкости
двухвалентными катионами. Характерно, что при ионном обмене отсутствует селективность
в ряду Mg-Ca-Cu, что говорит об отсутствии химического взаимодействия с поверхностью.
Между тем, обменная емкость иллита намного охотнее заполняется двухвалентными
катионами, чем обменная емкость монтмориллонита. Дело в том, что обменные позиции
X на поверхности глинистого минерала расположены далеко
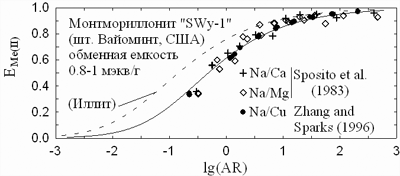 |
| Рис. 9. Эквивалентная доля двухзарядного катиона в обменной емкости
иллита (верхняя панель) и монтмориллонита (нижняя панель) как функция отношения
активностей катионов в растворе, AR = aMe/aNa2 |
друг от друга (расстояние между "лунками" на рис. 8 составляет
5 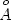 ). По этой причине, двухвалентный катион может занимать лишь одну обменную
позицию, и реальная стехиометрия ионного обмена имеет вид: ). По этой причине, двухвалентный катион может занимать лишь одну обменную
позицию, и реальная стехиометрия ионного обмена имеет вид:
2XNa+ + Ca2+  XCa2+ + X + 2Na+[2]
XCa2+ + X + 2Na+[2]
Общее количество обменных позиций на поверхности глинистого
минерала составляет 7 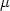 моль/м2. Заряд поверхности
монтмориллонита невелик (около 1.2 экв/м2),
поэтому почти все обменные позиции на его поверхности пусты (это не вполне точно:
на самом деле они заняты молекулами воды). Заряд поверхности иллита (около 3 моль/м2. Заряд поверхности
монтмориллонита невелик (около 1.2 экв/м2),
поэтому почти все обменные позиции на его поверхности пусты (это не вполне точно:
на самом деле они заняты молекулами воды). Заряд поверхности иллита (около 3
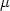 экв/м2) близок к таковому у мусковита, поэтому обменные
катионы занимают почти половину от общего количества обменных позиций. В одном
и том же растворе, на поверхности иллита и монтмориллонита произведение [X][XCa2+]/[XNa+]2
на самом деле одинаково, но поскольку X для монтмориллонита больше, то XCa2+,
соответственно, меньше, чем для иллита. Расчетные кривые обмена на рис. 9 выполнены
при одном и том же значении константы обмена согласно реакции [2]. экв/м2) близок к таковому у мусковита, поэтому обменные
катионы занимают почти половину от общего количества обменных позиций. В одном
и том же растворе, на поверхности иллита и монтмориллонита произведение [X][XCa2+]/[XNa+]2
на самом деле одинаково, но поскольку X для монтмориллонита больше, то XCa2+,
соответственно, меньше, чем для иллита. Расчетные кривые обмена на рис. 9 выполнены
при одном и том же значении константы обмена согласно реакции [2].
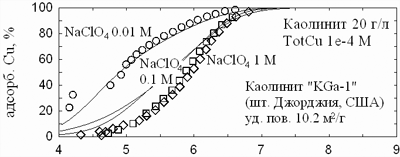
На рис. 10 показаны данные по адсорбции меди и кадмия на поверхности каолинита
(Schindler et al, 1987). В кислой области рН-зависимая сорбция обусловлена замещением
H/Me в обменной емкости. В близнейтральной области протоны вытесняются из обменной
емкости ионами натрия. Поскольку обмен Na/Me не зависит от рН, сорбционные кривые
выполаживаются. При более высоких значениях рН возникает перегиб сорбционных кривых,
обусловленный химической сорбцией.
 |
| Рис. 10. Адсорбция меди (верхняя панель) и кадмия (нижняя панель)
на каолините. Данные Schindler et al., 1987. |
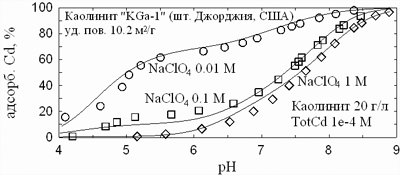
Последнюю легко отличить по
слабой зависимости от ионной силы, сильной зависимости от рН, и химической специфике
(хорошо заметно, что химическая сорбция кадмия проявлена намного слабее, чем
у меди). При высоких ионных силах ионный обмен подавляется, и остается лишь
эффект химической сорбции.
 |
| Рис. 11. Адсорбция кадмия на каолините в атмосфере аргона и в присутствии
атмосферного воздуха. Данные автора. |
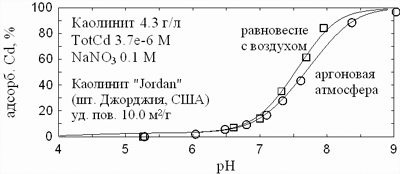
На рис. 11 показано влияние атмосферной углекислоты на химическую сорбцию кадмия
на каолините (ионный обмен практически полностью подавлен высокой ионной силой).
Некоторый эффект есть, но он намного меньше, чем при адсорбции на гематите.
По всей видимости, анионы сорбируются на глинистых минералах слабее, чем на
поверхности гематита. Поэтому и эффект взаимной компенсации зарядов довольно
незначителен.
|

