6.1. Связь кипения и рудообразования. Краткий обзор проблемы
Кипение (в
общем случае - гетерогенизация флюида1) в гидротермальных системах
традиционно считается одним из ведущих факторов, контролирующих их
рудоносность. Описано несколько механизмов влияния кипения на рудоотложение.
"Потеря комплексообразователя". Наиболее
популярный в геохимической литературе механизм воздействия кипения на рудное
вещество связан с переходом в газовую фазу компонентов, служащих лигандами для
комплексных форм переноса рудных металлов. Разрушение комплексных форм приводит
к отложению рудных минералов по реакции типа:
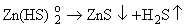 (6.1) (6.1)
Примером
действия такого механизма может быть осаждение урана из карбонатных комплексов
при дегазации раствора с потерей CO2.
"Потеря осадителя". Некоторые анионогенные
рудные компоненты (в первую очередь, H2S и CO2) обладают
высокой летучестью и при кипении легко переходят в газовую фазу. Если в
контакте с гетерогенным флюидом находится соответствующий рудный минерал,
потеря осадителя вызовет его растворение по реакции типа:
 (6.2) (6.2)
Очевидно,
потеря осадителя препятствует рудоотложению при кипении. Этот эффект кипения
остается, как правило, за рамками рассмотрения исследователей, поскольку он
приводит не к осаждению, а к мобилизации рудного вещества. Между тем такой
способ воздействия кипения важен для халькофильных элементов, осадитель которых
- SII, легко может теряться в паровую фазу в виде H2S.
Существенно, что в результате действия этого механизма рудоотложение будет
происходить не при кипении, а при обратном процессе - конденсации пара. Пример
такого процесса рассмотрен в работе [Бычков, Гричук, 1991] в отношении
осаждения As и Sb в гидротермах кальдеры Узон (Камчатка).
"Сдвиг рН и Eh". Переход в газовую фазу веществ, содержащих элементы
переменной валентности и веществ, способных к электролитической диссоциации в
водной фазе может привести к изменению окислительно-восстановительного и
кислотно-основного состояний системы, что в свою очередь, отразится на
поведении рудных компонентов. Примером этого может служить реакция:
 (6.3) (6.3)
Сдвиг рН и Eh
неоднократно привлекался для объяснения причин отложения золота [Cunningham,
1985; Cline et al., 1992]. Однако, влияние такого механизма на поведение рудных
компонентов, в отличие от "потери комплексообразователя", неоднозначно - за
счет него рудные минералы могут и осаждаться, и растворяться.
Для
распространенных в гидротермальных растворах элементов переменной валентности
характерно большее сродство к газовой фазе в соединениях низшей валентности (H2S,
CH4, H2). Поэтому вскипание гидротермальных растворов,
как правило, сопровождается сдвигом состояния раствора в окислительную сторону.
Для некоторых рудных элементов (Au, Ag, U) это должно благоприятствовать
растворению их наиболее распространенных минералов, для других, напротив, будет
вызывать осаждение (Fe, Mn).
Таким важным
компонентам гидротермальных растворов, как H2S и H2CO3
свойственна диссоциация по кислотному типу. Перераспределение их
диссоциированных форм в газ будет вызывать подщелачивание остаточного раствора:
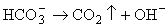 (6.4) (6.4)
Для рудных
минералов - сульфидов, карбонатов и оксидов подщелачивание благоприятствует
осаждению.
"Потеря растворителя". Выкипание жидкости
и увеличение вследствие этого концентрации жидкой фазы ведет к осаждению минералов.
Для некоторых компонентов гидротермальных растворов, например, SiO2,
это, вероятно, один из главных механизмов отложения [Кигай, 1989].
Соответственно, обратный процесс - конденсация пара -дает
маломинерализованный раствор, который может оказаться агрессивным по отношению
к окружающим породам. Однако, для тех рудных компонентов, которые присутствуют
в растворе в комплексных формах с большим числом лигандов, в первую очередь -
хлоридов (Fe, Zn, Cu, Pb), концентрирование раствора может приводить к усилению
комплексообразования и растворению твердых фаз.
"Ограничение по Т и Р". Помимо чисто химических взаимодействий, кипение связано с
сильными теплофизическими эффектами. При разгрузке двухфазного гидротермального
флюида температура его зависит от давления по Т-Р-кривой кипения. Подъем
такого флюида к поверхности будет сопровождаться снижением давления, а,
следовательно - и сильным охлаждением. Для большинства рудных
компонентов охлаждение ведет к отложению твердых фаз. Такого рода ограничение
рассматривалось, в частности, как важный фактор, определяющий глубину моря при
образовании колчеданных месторождений [Ridge, 1973; Finlow-Bates, Large, 1978;
Краснов, 1987].
Кроме
перечисленных механизмов, кипение может, вероятно, и другими путями влиять на
поведение рудных минералов. Так, в последнее время в геохимической литературе
активно обсуждается воздействие макросостава гидротермальных растворов на
рудные компоненты через изменение диэлектрической проницаемости раствора
[Колонин и др., 1994; Акинфиев, 1994]. Отделение CO2 в газовую фазу
будет, вероятно, вызывать эффект такого рода, однако прогнозировать его
масштабы в природных процессах сейчас еще затруднительно.
Конкуренция механизмов. Сложность проблемы кипения
в значительной мере обусловлена тем, что такие важные компоненты
гидротермальных растворов, как H2S и CO2 способны при
кипении влиять на рудное вещество одновременно по разным механизмам. Например,
H2S может быть одновременно и осадителем, и комлексообразователем.
При этом, поскольку направления воздействия у соответствующих механизмов
противоположны, возникает конкуренция их влияний, и результирующий эффект не
может быть определен a priori. Он
будет зависеть от условий процесса кипения и состава системы.
В ряде случаев
возможен логический анализ такой конкуренции. Так, если преобладающая форма
цинка в растворе - свободный ион или хлоридные комплексы, вскипание раствора
интенсифицирует реакции (6.2) и (6.5):
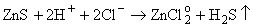 (6.5) (6.5)
При этом
рудоотложение не происходит, более того, присутствующий рудный минерал будет
растворяться. Аналогично идет процесс и в случае преобладания формы
ZnHS+:
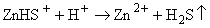 .(6.6) .(6.6)
Если же в
растворе преобладает частица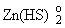 , то протекает реакция (6.1), и рудная фаза при кипении
отлагается. , то протекает реакция (6.1), и рудная фаза при кипении
отлагается.
Более сложная
задача возникла при анализе поведения золота при кипении [Drummond, Ohmoto,
1985]. В отсутствие комплексообразователей кипение провоцирует реакцию (6.3),
идущую с растворением золота. Однако в гидротермальных растворах в широком интервале
условий преобладает форма 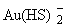 , и потеря комплексообразователя вызывает реакцию: , и потеря комплексообразователя вызывает реакцию:
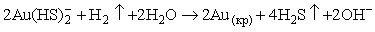 (6.7) (6.7)
Если допустить
постоянство рН жидкости и состава отделяющейся газовой фазы, то константа
равновесия реакции (6.7) может быть представлена, как
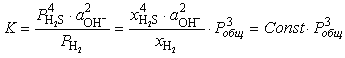 , (6.8) , (6.8)
где Pi - парциальное давление, а xi - мольная доля в газе i-того компонента.
Таким образом,
падение давления (усиление кипения) сдвигает реакцию вправо, в сторону
осаждения золота. Потеря комплексообразователя оказывается важнее, чем сдвиг
окислительно-восстановительного состояния системы. Однако допущения о
постоянстве рН и состава газа (последнее - особенно) в значительной
степени обесценивают этот вывод. Заметим также, что в реакции (6.3) подкисление
системы способствует растворению золота, а в реакции (6.7) - осаждению.
Из числа
названных в предыдущем разделе механизмов для трех - влияние на рудное веществ
однозначно: "потеря комплексообразователя" и адиабатическое охлаждение
способствуют осаждению рудного вещества, "потеря осадителя" - растворению.
Действие других механизмов знакопеременно в зависимости от природы рудных
компонентов.
В работе
[Drummond, Ohmoto, 1985] было показано, что буферирование рН веществами,
присутствующими в растворе и/или твердыми фазами также способно влиять на
поведение рудного вещества при кипении. Кроме того, в той же работе было
показано, что если система открыта по паровой фазе (происходит ее удаление),
потеря сильно летучих компонентов протекает более интенсивно на начальной
стадии кипения. Соответственно, соотношение механизмов может меняться в
процессе выкипания жидкости.
Учет этого
многообразия вынуждает включать в рассмотрение одновременно большое число
компонентов, и подобная работа не может быть выполнена на уровне логических
построений - "вручную". Для исследования таких систем требуется
применение термодинамического моделирования на ЭВМ.
Термодинамическое моделирование кипения
гидротермальных растворов. Ключевую роль в развитии современных представлений о связи кипения и
рудообразования сыграла пионерская работа С.Драммонда и Х.Омото [Drummond,
Ohmoto, 1985], в которой был использован термодинамический расчет равновесий в
гетерофазной системе. Метод Драммонда и Омото был основан на использовании
констант межфазного распределения (констант Генри) компонентов, что позволило
включить их в расчет равновесного состояния системы "на константах". В этой
работе было продемонстрировано, что кипение в открытых системах (с отгонкой
паровой фазы) более эффективно в отношении рудообразования, чем в закрытых.
Были выявлены геохимические признаки, позволяющие идентифицировать продукты
рудоотложения при кипении.
Термодинамическая
модель с адиабатическим кипением была построена Н.Спичером и М.Ридом [Spycher,
Reed, 1989] на примере геотермальной системы Бродлендс. Ими было показано, что
отделение летучих компонентов вызывает изменение рН раствора и, действуя совместно
с изменением температуры, приводит к осаждению сульфидов и сульфосолей,
карбонатов, а также самородного золота.
В работе
Т.Бауэрс [Bowers, 1991] рассмотрено влияние гетерогенизации в системах,
содержащих много CO2 на отложение золота и сульфидов цветных
металлов. Модель в этой работе была ограничена рассмотрением газовой фазы,
содержащей только 3 компонента (H2O, CO2, H2S),
зато она включала сложную 17-элементную мультисистему, описывающую жидкую и
твердые фазы. В этой работе было получено, что кипение в контакте с породой
влияет на рудные элементы иначе, чем без этого контакта из-за буферирующего
действия алюмосиликатных минералов.
Все внимание исследователей в цитированных выше публикациях было сосредоточено
на вопросе отложения рудных элементов. Вопрос о мобилизации рудного вещества
при вскипании раствора в них не рассматривался. Модели гидротермальных систем,
в которых при кипении рудное вещество растворяется, рассматривались в работах
[Бычков, Гричук, 1991; Grichuk, Shvarov, 1992]. Некоторые результаты исследования
этих моделей будут приведены ниже.
|

