|
Ныс П.С., Курочкина В.Б., Скляренко А.В., Вейнберг Г.А. Государственный научный центр по антибиотикам, Москва, Россия, Латвийский институт органического синтеза, Рига,
Латвия
В начало...
(Окончание)
4. Монобактамы
Монобактам (9) - наиболее перспективный представитель моноциклических беталактамных антибиотиков природного происхождения. Его гетероциклический скелет - монобактам или азетидинон-2. Открытие монобактама опровергло бытовавшее мнение о невозможности проявления антибактериальных свойств изолированным беталактамным циклом без <поддержки> конденсированной с ним гетероциклической или карбациклической системы. Рассмотрим роль заместителей в различных положениях монобактама в биологической активности производных.
Положение N(1). Основная роль кислотного заместителя (чаще всего - SO3H) у амидного азота монобактама сводится к ослаблению ациламидной связи в беталактамном кольце, чрезвычайно стабильной в неактивном N-незамещенном азетидиноне-2. Замена сульфонильной группы на другие электроноакцепторные заместители не приводит к существенному изменению антибактериальной активности производных.
Положение С(3). Модификация N-ацильного фрагмента в 3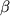 положении монобактама (3S-конфигурация), как и в случае пенициллинов и цефалоспоринов, является наиболее эффективным способом воздействия на антибактериальные свойства производных. Наиболее активными оказались монобактамы, N-ацильный фрагмент которых, заимствован у цефалоспоринов третьего и четвертого поколений. Стереоизомерные производные, имеющие 3R-конфигурацию, не активны. Введение метокси- и N-формиламиногрупп в 3 положении монобактама (3S-конфигурация), как и в случае пенициллинов и цефалоспоринов, является наиболее эффективным способом воздействия на антибактериальные свойства производных. Наиболее активными оказались монобактамы, N-ацильный фрагмент которых, заимствован у цефалоспоринов третьего и четвертого поколений. Стереоизомерные производные, имеющие 3R-конфигурацию, не активны. Введение метокси- и N-формиламиногрупп в 3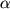 положение приводит к повышению устойчивости антибиотиков к бета-лактамазам, также, как и в случае пенициллинов и цефалоспоринов. положение приводит к повышению устойчивости антибиотиков к бета-лактамазам, также, как и в случае пенициллинов и цефалоспоринов.
Введение метильной или карбамоилоксиметильной групп в С(4) положение монобактама способствует увеличению устойчивости производных к бета-лактамазам. Однако увеличение размера заместителя параллельно с повышением устойчивости к бета-лактамазам снижает антибактериальную активность антибиотиков.
5. Ингибиторы бета-лактамаз
Наиболее эффективным неконкурентным ингибитором бета-лактамаз различной этиологии является клавулановая кислота (6), получаемая биосинтетически. Будучи малоактивным антибиотиком, она находит широкое применение в клинической практике для борьбы с бета-лактамазной резистентностью микроорганизмов. Гетероциклический скелет клавулановой кислоты - клавам (см. рис. 1,?3). Рассмотрим влияние некоторых структурных изменений в клавулановой кислоте на ингибирующую активность получаемых производных [17, 20].
Положения О(1) и С(2). 1-Тиоаналог клавулановой кислоты и ее производные с гидрированной экзоциклической двойной связью обладают менее выраженными ингибирующими свойствами, чем природное соединение.
Положение С(3). Превращение карбоксильной группы в метиловый или бензиловый эфиры не изменяет биологических свойств соединения. Аналогичный эффект наблюдается при декарбоксилировании клавулановой кислоты.
Положение С(9). Наиболее эффективным способом улучшения ингибирующего действия клавулановой кислоты является модификация заместителей в С(9) положении клавама (см. рис. 1, (6)). Замена гидроксильной группы на амино-, дибензиламино-, фенил-, N-формиламино- приводит к значительному усилению ингибирующих свойств производных.
Обширный литературный материал по механизмам действия беталактамных антибиотиков и механизмам антибиотикорезистентности позволил провести систематизацию сведений, касающихся взаимосвязи структуры и биологической активности антибиотиков. Изучение зависимости биологической активности от структурных особенностей беталактамных антибиотиков позволяет сформулировать основные принципы конструирования новых беталактамов и создать методологию их поиска. В свою очередь методология поиска облегчает конструирование новых структур и способствует решению <пенициллиновой проблемы>, по-прежнему актуальной в связи с адаптационными способностями эволюционирующих микроорганизмов.
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 2000-N11, стр. 36-42.
1. Elks J. Structural formula and nomenclature of the cephalosporin antibiotics: Append I. Drugs 1987; Suppl 2: 240-246.
2. Elks J. Cephalosporins under development: Append II. Ibid 248-252.
3. Van Krimpen P.C., Van Bennekom W.P., Bult A. Penicillins and cephalosporins: Physicochemical properties and analysis in pharmaceutical and biological matrices. Pharmaceut Weekblad 1987; 9: 1-23.
4. Sebek O.K. Antibiotics. V. Michigan 1986; 7: 240-276.
5. Wolfe S., Demain A.L., Jensen S.E., Westlake D.W.S. Enzymatic approach to synthesis of unnatural beta-lactam. Science 1984; 226: 1386-1392.
6. Page M.I. The mechanisms of reactions of 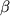 -lactam antibiotics. Advan Phys Organic Chem 1987; 23: 165-270. -lactam antibiotics. Advan Phys Organic Chem 1987; 23: 165-270.
7. Ghuysen J.M. Molecular structures of penicillin-binding proteins and beta-lactamases. Trends Microbiol 1994; 2: 372-380.
8. Bush K., Jacoby G.A., Medeiros A.A. A functional classification scheme for 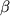 -lactamases and its correlation with molecular structure. Antimicrob Agents Chemother 1995; 1211-1233. -lactamases and its correlation with molecular structure. Antimicrob Agents Chemother 1995; 1211-1233.
9. Fontano R., Valisena S., Cornaglia G. Comparative affinities for penicillin-binding proteins of multipolar ionic amphoteric cephalosporins in Gram-negative bacteria. J Chemother 1996; 8: Suppl 2: 23-30.
10. James P.A., Reeves D.S. Bacterial resistance to cephalosporins as a function of outer membrane permeability and access to their target. Ibid 37-47.
11. Навашин С.М., Фомина И.П. Полусинтетические пенициллины. М 1974; 16-51.
12. Laws A., Page M. The chemistry and structure activity relationship of C-3 quaternary ammonium cephem antibiotics. J Chemother 1996; 8: Suppl 2: 7-22.
13. Nukaga M., Haruta S., Tanimoto K. Molecular evolution of a class C 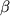 -lactamase extending its substrate specifity. J Biol Chem 1995; 270: 5729-5735. -lactamase extending its substrate specifity. J Biol Chem 1995; 270: 5729-5735.
14. Medeiros A.A. Evolution and dissemination of 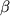 -lactamases accelerated by generation of -lactamases accelerated by generation of 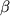 -lactam antibiotics. Clin Infect Dis 1997; 24:Suppl 1: S19-S45. -lactam antibiotics. Clin Infect Dis 1997; 24:Suppl 1: S19-S45.
15. Massova I., Mobashery S. Kinship and diversitification of bacterial penicillin-binding proteins and 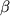 -lactamases. Antimicrob Agents Chemother 1998: 1-17. -lactamases. Antimicrob Agents Chemother 1998: 1-17.
16. Ныс П.С., Бартошевич Ю.Э. Основы разработки биокаталитических процессов транформации и синтеза беталактамных антибиотиков. Антибиотики и химиотер 1992; 12: 3-18.
17. Вейнберг Г.А., Кофман А.М., Люкевикс Е. Прогноз активности беталактамных антибиотиков. Хим гетероцикл соед 1992; 4: 555-564.
18. Sutherland R. Betalactams: Penicillins: Antibiotic and Chemotherapy. Anti-infective agents and their use in therapy./O'Grady F., Lambert H.P., Finch R.G., Greenwood D. eds. 7ed New York; Edinburg; London; Madrid; Melbourne; San Francisco; Tokyo 1997; Ch 15: 256-305.
19. Wise R. Betalactams: Cephalosporins. Ibid Ch.14: 202. 20. Bush K. Other betalactams. Ibid Ch 16: 306-327.
21. Periti P. Introduction: Cephalosporin generations. J Chemother 1996; 8: Suppl 2: 3-6.
22. Chemistry and Pharmacy Overview - Meropenem. Technical Monograph. Zeneca LTD 1997; 86-89.
Написать комментарий
| 
