|
Никитин А.В. Редакционные статьи
В начало...
Успехи химиотерапии инфекционных заболеваний на современном этапе самым тесным образом связаны с изучением патофизиологических и иммунопатологических механизмов воспалительных реакций при инфекционном процессе. В настоящее время четко прослеживается тенденция к созданию возможно более полной интегральной картины взаимодействия факторов патогенности возбудителей, механизмов неспецифической резистентности и иммунитета, клеточных и гуморальных эффекторов воспаления и влияния на эти процессы химиотерапевтических препаратов, что служит важной предпосылкой рационализации схем этиотропной и патогенетической терапии.
Большое число экспериментальных данных и клинических наблюдений аргументированно свидетельствует о том, что антибиотики и химиопрепараты различных групп, наряду со специфическим противомикробным действием, характеризуются иммуномодулирующими эффектами, а также обладают выраженным регуляторным действием на функции клеток - эффекторов воспаления и различных медиаторов межклеточных взаимодействий. Одним из наиболее грозных осложнений для организма при инфекционной патологии является сепсис, на примере которого становятся очевидными разнообразие и сложность взаимодействий клеточных и гуморальных факторов, участвующих в воспалительном процессе. В качестве главных факторов воспаления выступают система клеток моноцитарного ряда, нейтрофилы, система комплемента, факторы свертывания крови, калликреин - кининовая система, фактор активации тромбоцитов, цитокины (противовоспалительные: интерлейкины-1, 6 и 8, 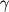 -интерферон, фактор некроза опухоли и обладающие противовоспалительным действием интерлейкины-4 и 10, -интерферон, фактор некроза опухоли и обладающие противовоспалительным действием интерлейкины-4 и 10, 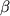 -трансформирующий ростовой фактор). Весьма важным представляется взаимодействие активированных лейкоцитов с клетками эндотелия сосудов. В последнее время внимание исследователей привлекает роль эндогенного оксида азота как важного полифункционального регулятора воспалительной реакции и эндотоксемического шока. -трансформирующий ростовой фактор). Весьма важным представляется взаимодействие активированных лейкоцитов с клетками эндотелия сосудов. В последнее время внимание исследователей привлекает роль эндогенного оксида азота как важного полифункционального регулятора воспалительной реакции и эндотоксемического шока.
Фундаментальной характеристикой действия антибиотиков на клетки макроорганизма и, в частности, на многие из указанных звеньев воспалительного процесса является наличие определенной дозозависимости эффекта (активации нейтрофилов, макрофагов, лимфоцитов и т.д.) от концентрации, который, как правило, возрастает до определенного максимального уровня, а затем по мере увеличения концентрации препарата снижается и может, в ряде случаев, измениться на противоположный (колоколообразная зависимость). С другой стороны, действие антибиотика на клетки макроорганизма во многом зависит от их исходного функционального состояния на той или иной стадии воспалительного процесса. Таким образом, конечный результат действия антибиотика на клетки определяется как локальной концентрацией препарата в очаге воспаления и в клетке, так и стадией функционального состояния клетки - эффектора.
Разумеется, оценка указанных параметров в очаге воспаления in vivo весьма затруднительна. Поэтому прогноз влияния антибиотиков и других химиопрепаратов на стадии воспалительного процесса строится на сегодняшний день лишь на основании косвенных экспериментальных данных, в большинстве своем полученных в экспериментах in vitro при дискретном, хотя и достаточно широком, наборе концентраций препарата.
Несмотря на указанные методологические трудности, к настоящему времени получены данные о важной регуляторной роли антибиотиков в воспалительных реакциях организма. Так, представитель группы цефалоспориновых антибиотиков цефодизим, обладающий рядом ценных иммуностимулирующих свойств, не увеличивает образование цитокинов, но оказывает модулирующий эффект в случае избыточного выделения фактора некроза опухоли и интерлейкина-1 при воспалительных процессах. Другие цефалоспорины - цефаклор, цефетамет и препарат RO-4968-90 усиливают фагоцитоз, внутриклеточный киллинг микроорганизмов и оказывают регулирующее действие на высвобождение медиаторов, участвующих в воспалительных реакциях. Особенно активен в этом отношении цефаклор. Антибиотик подавляет образование лейкотриена В4 гранулоцитами человека в условиях их стимуляции кальциевым ионофором А 23187 или бактериальными клетками. Установлено, что лейкотриен В4 является эффективным стимулятором хемотаксиса, в принципе необходимым для проявления нормальных защитных функций лейкоцитов, однако его избыточное образование может приводить к развитию хронических воспалительных процессов. Между названными цефалоспоринами имеются различия по этому эффекту. Так, цефаклор подавляет образование лейкотриена В4 гранулоцитами человека, тогда как цефетамет и RO-4968-90 снижают избыточную продукцию этого медиатора, а также образование кислородных радикалов и гистамина. Кроме того, все три цефалоспорина снижают секрецию цитокинов (интерлейкина-6, 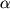 -фактора некроза опухоли) лимфоцитами, моноцитами и базофилами. -фактора некроза опухоли) лимфоцитами, моноцитами и базофилами.
В последнее время получены данные о том, что цефтазидим участвует в защите плазматических ингибиторов протеаз (антипротеаз) от инактивации активными формами кислорода. Известно, что избыточная активация полиморфноядерных лейкоцитов при остром воспалении приводит к образованию активных форм кислорода и выходу ферментов из клеток. Основными ферментами в данном случае являются миелопероксидаза, которая образует хлорноватистую кислоту из перекиси водорода и ионов хлора, и эластаза. Избыточная активность протеолитических ферментов регулируется 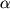 1-антипротеиназой, специфичной для эластазы, и 1-антипротеиназой, специфичной для эластазы, и 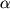 2-макроглобулином(регулирующим активность протеиназ крови). Избыточная активность полиморфноядерных лейкоцитов и миелопероксидазы приводит к их инактивации. Установлено, что цефтазидим снижает избыточную активность миелопероксидазы и предохраняет 2-макроглобулином(регулирующим активность протеиназ крови). Избыточная активность полиморфноядерных лейкоцитов и миелопероксидазы приводит к их инактивации. Установлено, что цефтазидим снижает избыточную активность миелопероксидазы и предохраняет 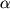 2-макроглобулин от окислительного стресса. Таким образом, наряду с иммуномодулирующими свойствами цефалоспорины характеризуются важным модулирующим противовоспалительным эффектом. 2-макроглобулин от окислительного стресса. Таким образом, наряду с иммуномодулирующими свойствами цефалоспорины характеризуются важным модулирующим противовоспалительным эффектом.
Макролидные антибиотики обладают рядом ценных фармакологических эффектов, направленных на модуляцию медиаторов воспаления, синтезируемых макрофагами, нейтрофилами и другими клетками. Так, азитромицин накапливается в высоких концентрациях в нейтрофилах и переносится ими в инфекционный очаг, где под действием ряда медиаторов воспаления, антигенов и других стимулов происходит выход антибиотика из клеток, что приводит к созданию повышенных концентраций препарата в очаге инфекции. Антибиотик также накапливается в фибробластах, секретирующих и связывающих фибронектин, который, как известно, облегчает адгезию микроорганизмов на эпителиальных клетках. В случае выделения азитромицина фибробластами адгезия снижается, что является дополнительным фактором антимикробного эффекта препарата. Азитромицин подавляет образование форм активированного кислорода в нейтрофилах, адгезированных на эндотелии сосудов при воспалении, и таким образом уменьшает повреждение сосудов, вызванное активированными лейкоцитами. Рокситромицин подавляет синтез интерлейкина-8 макрофагоподобными клетками. Антибиотик снижает экспрессию адгезинов комплекса МАС-1 на мембранах нейтрофилов, снижает цитокинзависимую индукцию гистидиндекарбоксилазы, что приводит к снижению уровня гистамина и, соответственно, уменьшению воспалительной реакции. Макролиды снижают в клетках уровень информационных РНК для интерлейкина 1-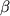 , интерлейкина-8. Рокситромицин, кларитромицин и азитромицин ослабляют повреждающее действие физиологически активных фосфолипидов: фактора активации тромбоцитов (ФАТ), лизо-ФАТ и лизофосфатидилхолина на эпителий дыхательных путей человека in vitro, что дает возможность сделать вывод о протективном действии макролидов и азалидов на дыхательные пути при астме или бактериальных инфекциях, опосредованных активными формами кислорода, которые образуются в фагоцитирующих клетках, активированных фосфолипидами. Ванкомицин подавляет образование , интерлейкина-8. Рокситромицин, кларитромицин и азитромицин ослабляют повреждающее действие физиологически активных фосфолипидов: фактора активации тромбоцитов (ФАТ), лизо-ФАТ и лизофосфатидилхолина на эпителий дыхательных путей человека in vitro, что дает возможность сделать вывод о протективном действии макролидов и азалидов на дыхательные пути при астме или бактериальных инфекциях, опосредованных активными формами кислорода, которые образуются в фагоцитирующих клетках, активированных фосфолипидами. Ванкомицин подавляет образование 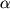 -фактора некроза опухоли в моноцитах, стимулированных липополисахаридом. Установлено, что ряд полусинтетических производных рифампицинов подавляют образование супероксиданиона, стимулированное форболмиристатацетатом, что может рассматриваться как важный фактор их противовоспалительного действия. -фактора некроза опухоли в моноцитах, стимулированных липополисахаридом. Установлено, что ряд полусинтетических производных рифампицинов подавляют образование супероксиданиона, стимулированное форболмиристатацетатом, что может рассматриваться как важный фактор их противовоспалительного действия.
Приведенные данные о противовоспалительном действии антибиотиков различных групп в совокупности с результатами детального изучения их иммуномодулирующей активности, проведенного в ГНЦА за последние годы, дают основания сделать вывод о том, что наряду со специфическим противомикробным действием современные антибиотики (беталактамы, макролиды, азалиды, рифамицины и др.) являются эффективными регуляторами отдельных этапов и звеньев воспалительных реакций при инфекционном процессе. Актуальной задачей в исследовании данного вида фармакологической активности является дальнейшая разработка экспериментальных моделей и методов количественной оценки эффектов препаратов, создающих основу для совершенствования схем патогенетической терапии инфекционных заболеваний.
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 1998-N9, стр. 2-4.
Написать комментарий
|

