Если взять купюру и посмотреть на неё
под ультрафиолетовым излучением - вот
и я собственно не могу понять как и по какой
причине узоры на купюре в разных
цветах,
причиной которому по аналогии
можно было отнести к реликтовому излучению
пространства.
---
\\\Материал из Википедии свободной энциклопедии
Материал из Википедии свободной энциклопедии
Флуоресце́нция (вариант: флюоресценция) физический процесс, разновидность люминесценции.
Флуоресценцией обычно называют излучательный переход возбужденного
состояния с самого нижнего синглетного колебательного уровня S1 в основное состояние S0. В общем случае флуоресценцией называют разрешенный
по спину излучательный переход между двумя
состояниями одинаковой мультиплетности: между синглетными уровнями 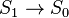 или триплетными
или триплетными  . Типичное
время жизни такого возбужденного
состояния составляет 10−11−10−6 с.
. Типичное
время жизни такого возбужденного
состояния составляет 10−11−10−6 с.
Флуоресценцию следует отличать от фосфоресценции
запрещенного по спину излучательного перехода между двумя состояниями
разной мультиплетности. Например, излучательный переход возбужденного
триплетного состояния T1 в основное состояние S0. Синглет-триплетные переходы имеют квантово-механический запрет, поэтому время
жизни возбужденного состояния при фосфоресценции составляет
порядка 10−3−10−2 с.
\\\
\\\
Согласно представлениям квантовой
химии, электроны в атомах расположены на энергетических
уровнях.
Расстояние между энергетическими уровнями в молекуле зависит от её
строения. При облучении вещества светом возможен переход электронов
между различными энергетическими уровнями. Разница энергии между
энергетическими уровнями и частота колебаний поглощенного света
соотносятся между собой уравнением (III постулат Бора):

После поглощения света часть полученной системой энергии расходуется в результате релаксации.
Часть же может быть испущена в виде фотона определённой энергии.
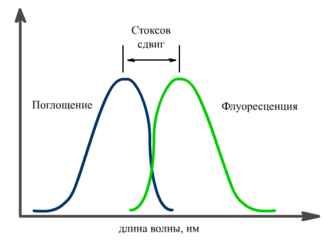
Спектр флуоресценции сдвинут относительно спектра поглощения в сторону длинных волн. Это явление получило название Стоксов
сдвиг.
Его причиной являются безызлучательные релаксационные процессы. В
результате часть энергии поглощенного фотона теряется, а испускаемый
фотон имеет меньшую энергию, и, соответственно, большую длину волны.[1]
Схематически процессы поглощения света и флуоресценции показывают на диаграмме Яблонского.
При нормальных условиях большинство молекул находятся в основном электронном состоянии  . При поглощении света молекула переходит в возбужденное состояние
. При поглощении света молекула переходит в возбужденное состояние  .
При возбуждении на высшие электронные и колебательные уровни избыток
энергии быстро расходуется, переводя флуорофор на самый нижний
колебательный подуровень состояния
.
При возбуждении на высшие электронные и колебательные уровни избыток
энергии быстро расходуется, переводя флуорофор на самый нижний
колебательный подуровень состояния  . Однако, существуют и исключения:
например, флуоресценция азулена может происходить как из
. Однако, существуют и исключения:
например, флуоресценция азулена может происходить как из  ,
так и из
,
так и из 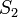 состояния.
состояния.
Квантовый выход флуоресценции показывает, с какой эффективностью
проходит данный процесс. Он определяется как отношение количества
испускаемых и поглощаемых фотонов. Квантовый выход флуоресценции может
быть рассчитан по формуле

где 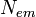 количество испускаемых в результате флуоресценции
фотонов, а
количество испускаемых в результате флуоресценции
фотонов, а 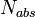 общее количество поглощаемых фотонов. Чем
больше квантовый выход флуорофора, тем интенсивнее его
флуоресценция. Квантовый выход можно также определить с помощью упрощенной диаграммы Яблонского[2],
где
общее количество поглощаемых фотонов. Чем
больше квантовый выход флуорофора, тем интенсивнее его
флуоресценция. Квантовый выход можно также определить с помощью упрощенной диаграммы Яблонского[2],
где 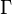 и
и 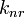 константы скорости излучательной и безызлучательной дезактивации возбужденного состояния.
константы скорости излучательной и безызлучательной дезактивации возбужденного состояния.
Тогда доля флуорофоров, возвращающихся в основное состояние с испусканием фотона, и, следовательно, квантовый выход:

Из последней формулы следует, что 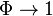 если
если
 ,
то есть если скорость безызлучательного перехода значительно меньше
скорости излучательного перехода. Отметим, что квантовый выход всегда
меньше единицы из-за стоксовых
потерь.\\\
,
то есть если скорость безызлучательного перехода значительно меньше
скорости излучательного перехода. Отметим, что квантовый выход всегда
меньше единицы из-за стоксовых
потерь.\\\


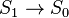 или триплетными
или триплетными  . Типичное
. Типичное


 . При поглощении света молекула переходит в возбужденное состояние
. При поглощении света молекула переходит в возбужденное состояние  .
При возбуждении на высшие электронные и колебательные уровни избыток
энергии быстро расходуется, переводя флуорофор на самый нижний
колебательный подуровень состояния
.
При возбуждении на высшие электронные и колебательные уровни избыток
энергии быстро расходуется, переводя флуорофор на самый нижний
колебательный подуровень состояния 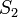 состояния.
состояния.
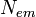 количество испускаемых в результате флуоресценции
фотонов, а
количество испускаемых в результате флуоресценции
фотонов, а 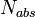 общее количество поглощаемых фотонов. Чем
больше квантовый выход
общее количество поглощаемых фотонов. Чем
больше квантовый выход 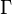 и
и 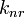 константы скорости излучательной и безызлучательной дезактивации возбужденного состояния.
константы скорости излучательной и безызлучательной дезактивации возбужденного состояния.
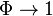 если
если
 ,
то есть если скорость безызлучательного перехода значительно меньше
скорости излучательного перехода. Отметим, что квантовый выход всегда
меньше единицы из-за
,
то есть если скорость безызлучательного перехода значительно меньше
скорости излучательного перехода. Отметим, что квантовый выход всегда
меньше единицы из-за