|
М.Н. Косов, И.И. Евсюкова НИИ акушерства и гинекологии им. Д.О. Отта РАМН, Санкт-Петербург
В начало...
Применение экзогенного сурфактанта в лечении синдрома дыхательных расстройств у новорожденных детей позволило существенно снизить смертность недоношенных детей при данной патологии и уменьшить частоту осложнений. Однако в ряде случаев его использование неэффективно. В статье рассматриваются факторы, влияющие на эффективность терапии сурфактантом: биохимический состав, методика введения, природа патологии, приведшей к возникновению дыхательной недостаточности. Указывается, что дальнейшая разработка проблемы эффективного применения сурфактанта должна идти по пути изыскания методов ранней диагностики ведущего патофизиологического механизма нарушения функции внешнего дыхания. В качестве такого метода предлагается использование капнографии, которая позволяет судить о состоянии альвеолярной вентиляции и легочного кровотока, предположить ведущий патофизиологический механизм и определить тактику оксигенотерапии.
Ключевые слова:
Применение экзогенного сурфактанта в терапии синдрома дыхательных расстройств у новорожденных детей, получившее в последние годы широкое распространение, позволило существенно снизить смертность недоношенных детей при данной патологии, частоту пневмоторакса, интерстициальной эмфиземы, бронхолегочной дисплазии и ретинопатии [1-4]. Однако у 20% детей введение экзогенного сурфактанта оказалось неэффективным [5]. В ряде случаев отмечено увеличение числа тяжелых внутрижелудочковых кровоизлияний и появление легочных кровоизлияний у глубоконедоношенных детей [6-8]. По мнению исследователей, эффективность экзогенного сурфактанта зависит от множества факторов: биохимического состава, методики введения, наличия веществ, инактивирующих сурфактант в дыхательных путях, но прежде всего - от степени структурной зрелости легких и природы патологии, приведшей к возникновению дыхательной недостаточности [9].
В настоящее время используются препараты экзогенного сурфактанта, полученные из амниотической жидкости человека или путем лаважа легких свиней (Curosurf) и крупного рогатого скота (Infasurf), а также синтетические (Exosurf, ALEC). Препараты естественного происхождения обладают наилучшими поверхностно-активными свойствами, содержат различные фосфолипиды, нейтральные жиры и белки, причем препараты сурфактанта из легких животных (Survanta, Infasurf, Curosurf) являются единственным классом, имеющим в своем составе гидрофобные низкомолекулярные белки SP-B и SP-C [10, 11]. Синтетические сурфактанты, не содержащие белок (Exosurf, ALEC), чувствительны к инактивации белками плазмы, особенно фибриногеном [12, 13]. Сравнительные испытания естественных и синтетических сурфактантов показали, что естественные препараты действуют быстрее, и поэтому их использование рекомендуется при тяжелом синдроме дыхательных расстройств [14].
Отечественные препараты сурфактанта из амниотической жидкости человека (сурфактант HL) и из легких крупного рогатого скота (сурфактант BL) также безопасны и эффективны при их использовании у недоношенных детей [15, 16]. Показано, что терапевтический эффект сурфактанта BL наступает через 3-4 ч после введения, а сурфактанта HL еще раньше [17]. Несмотря на то, что естественные сурфактанты дают быстрый и более выраженный эффект, их введение несет риск возникновения иммунологических реакций на чужеродный белок и опасность передачи специфических вирусных инфекций (ВИЧ-инфекция, цитомегалия и др.). Поэтому в широкой практике чаще используются синтетические аналоги, в частности - Exosurf [1]. При этом используется доза сурфактанта 50-200 мг/кг, которая, как полагают, полностью обеспечивает потребности новорожденного ребенка [18]. Она равна комбинированному пулу внутри- и внеклеточного сурфактанта в легком здорового доношенного новорожденного [18, 19].
В отношении времени введения сурфактанта в литературе существуют разные точки зрения. Одни исследователи считают, что при введении сурфактанта в первые минуты жизни ребенка происходит его наиболее равномерное распределение в незрелых легких за счет смешивания с фетальной легочной жидкостью, содержащейся в дыхательных путях [20, 21]. Однако показано, что введение сурфактанта в первые минуты жизни эффективно лишь у новорожденных, родившихся при сроке беременности 26 нед и меньше [22]. Кроме того, известно, что у детей, родившихся при сроке беременности 27-30 нед, тяжелый синдром дыхательных расстройств развивается лишь в 60-70% случаев, и поэтому вряд ли оправдано введение всем детям эндотрахеально сурфактанта сразу после рождения [22]. Эта позиция подтверждается данными литературы об отсутствии существенных различий показателей смертности, частоты бронхолегочной дисплазии и внутрижелудочковых кровоизлияний у детей, которым сурфактант вводился в первые минуты жизни и спустя 2-6 ч после рождения [23]. Поэтому большинство исследователей склоняются ко второй точке зрения и сурфактант вводят только при развитии соответствующих клинических и рентгенологических симптомов.
В настоящее время существует три методики введения сурфактанта в легкие: отдельными болюсами, путем длительной интратрахеальной инфузии и в виде аэрозоля с помощью небулайзера. Наиболее эффективным и распространенным методом считают болюсное введение. В эксперименте показано, что в нормальном легком распределение сурфактанта в большей степени зависит от объема введения, чем от концентрации препарата [24]. Это происходит в силу того, что сурфактант стремится к негомогенному распределению вследствие влияния гравитации, характера ветвления и диаметра дыхательных путей. При этом происходит довольно быстрое первоначальное распределение сурфактанта в легких, способствующее увеличению функциональной остаточной емкости и быстрому улучшению оксигенации [24]. Чем больше вводимый объем препарата, тем выше вероятность заполнения многочисленных мелких бронхов и лучше его распределение [5]. Введение большого объема препарата в трахею требует высокой профессиональной подготовки специалистов, так как можно вызвать обструкцию дыхательных путей, гипоксию и гиперкапнию [5]. При инфузии сурфактанта в течение 30-45 мин наблюдается его преимущественное отложение в верхних долях легкого, т.е. в тех участках легких, которые лучше вентилируются [14, 21]. Поскольку легкое новорожденного имеет тенденцию к созреванию от верхушки к основанию, то единицы с наилучшей вентиляцией располагаются в верхних долях легкого [21]. Таким образом, данный способ введения является менее эффективным, чем болюсный. То же можно отметить в отношении применения сурфактанта в виде аэрозоля. При данном способе введения бульшая часть препарата остается на стенках камеры небулайзера и интубационной трубки и в легкие попадает лишь 2,2% [25-27]. Внутри самих легких экзогенный сурфактант преимущественно откладывается в неповрежденных участках, что снижает эффект лечения [28]. Данные литературы подтверждают результаты наших наблюдений, которые показали, что лишь при болюсном методе достигался существенный и стойкий клинический эффект, тогда как при использовании аэрозоля улучшение не наступало или было кратковременным.
В связи с тем, что эффект от введенного экзогенного сурфактанта непродолжителен, ряд исследователей предлагают повторное введение препарата. Однако целесообразность этого подвергается сомнению ввиду того, что наличие эндогенного сурфактанта в легких замедляет распространение вводимого экзогенного сурфактанта [29]. Как только экзогенный сурфактант вступает в контакт с жидкой выстилкой дыхательных путей, он снижает поверхностное натяжение, приводя к возникновению градиента поверхностного натяжения вдоль границы воздух - жидкость. Этот градиент приводит к возникновению <потока Марангони>, переносящего сурфактант вдоль этой границы к областям с низкой концентрацией сурфактанта. Поэтому первая доза распределяется хорошо, но последующие уже медленнее [30].
Можно полагать, что дальнейшее совершенствование способов введения сурфактанта будет способствовать эффективности этого метода заместительной терапии. Однако наряду с этим не менее важной задачей остается разработка показаний и объективных критериев эффективности использования сурфактанта. В настоящее время сурфактант применяют для лечения синдрома аспирации мекония и внутриутробной пневмонии [31-35]. Известно, что при данной патологии нарушаются ресинтез и высвобождение экзогенного сурфактанта. Фосфолипазы и реактивные кислородные радикалы, вырабатываемые бактериями, угнетают функциональную активность сурфактанта и активируют перекисное окисление липидов сурфактанта [36]. Вирусы также нарушают продукцию сурфактанта альвеолярными клетками 2-го типа [37]. При бронхоальвеолярном лаваже у больных пневмонией отмечено снижение содержания фосфолипидов и белковых компонентов сурфактанта [38]. Особое значение принадлежит снижению содержания SP-A, который является потенциальным активатором макрофагов [39]. При пневмонии возрастает альвеолярная проницаемость, что способствует выходу в просвет альвеол белков плазмы крови и дальнейшему угнетению функции сурфактанта [40]. Предполагается, что роль экзогенного сурфактанта как модулятора иммунного ответа заключается в стимуляции миграции макрофагов и фагоцитоза, угнетении продукции провоспалительных цитокинов TNF- и IL-1 и IL-1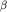 [41]. Имеются указания, что экзогенный сурфактант может непосредственно угнетать размножение бактерий [42]. Его применение у животных с экспериментальной пневмонией приводило не только к восстановлению поверхностного натяжения в альвеолах и улучшению оксигенации, но и к уменьшению морфологических проявлений воспаления [43]. [41]. Имеются указания, что экзогенный сурфактант может непосредственно угнетать размножение бактерий [42]. Его применение у животных с экспериментальной пневмонией приводило не только к восстановлению поверхностного натяжения в альвеолах и улучшению оксигенации, но и к уменьшению морфологических проявлений воспаления [43].
Однако расширение показаний к применению экзогенного сурфактанта поставило перед клиницистами еще больше вопросов, касающихся определения четких критериев необходимости его использования при различных формах патологии легких. Это тем более важно, поскольку в эксперименте показано, что профилактическое внутритрахеальное введение сурфактанта сопровождается усилением оводнения легких животных при эндогенных воздействиях, особенно в условиях дегидратации. В то же время введение его на фоне патологических изменений легочной мембраны и уже развившегося отека легких вызывает снижение интенсивности оводнения и улучшает функцию легких [44]. Не случайно, что введение сурфактанта всем недоношенным детям с целью профилактики синдрома дыхательных расстройств оказалось неоправданным в 30-40% случаев [5]. В связи с этим большинство исследователей делают акцент на раннем использовании сурфактанта только у новорожденных, относящихся к группе высокого риска развития дыхательных расстройств, предлагая выделять ее путем оценки степени зрелости легких плода к моменту родов или у ребенка сразу после рождения с помощью <пенного теста> [45]. Рекомендуется также использовать методы мониторного контроля (насыщение гемоглобина кислородом, напряжение кислорода и углекислого газа в тканях) для выявления изменений и определения момента ухудшения состояния функции внешнего дыхания и перевода ребенка на ИВЛ [46]. Таким образом, становится ясным, что дальнейшая разработка проблемы должна идти по пути изыскания методов ранней диагностики ведущего патофизиологического механизма нарушений функции внешнего дыхания. Известно, что по величине СО2 в выдыхаемом воздухе можно судить об уровне альвеолярной вентиляции и легочного кровотока [47]. Сопоставляя данные мониторного контроля содержания СО2 в конечной порции выдыхаемого воздуха в первые 2 ч жизни ребенка с особенностями ранней неонатальной адаптации и развитием у ряда детей дыхательных расстройств, мы пришли к выводу о целесообразности использования данного метода для суждения о том, как осуществляется становление функции внешнего дыхания после рождения и каков патофизиологический механизм наблюдаемых нарушений. Так, увеличение экскреции СО2 из легких спустя 30 мин после рождения (СО2>5 об% при норме 4,1-5,0 об%), свидетельствующее о снижении альвеолярной вентиляции, наблюдалось у недоношенных детей, у которых в последующие часы жизни развился типичный синдром дыхательных расстройств [48]. Известно, что при недостаточности сурфактантной системы легких развитие синдрома дыхательных расстройств характеризуется прогрессирующим уменьшением функциональной остаточной емкости, что приводит к снижению альвеолярной вентиляции, накоплению СО2, следствием чего является увеличение концентрации СО2 в конечной порции выдыхаемого воздуха. Прогрессирующее увеличение парциального давления СО2 в альвеолах сопровождается уменьшением парциального давления О2, что ведет к сужению легочных сосудов и перераспределению кровотока [49]. На этой стадии мы наблюдали манифестную клиническую картину синдрома дыхательных расстройств. В тех же случаях, когда в генезе дыхательных расстройств ведущую роль играет внутриутробная инфекция, гемодинамические нарушения в легких являются первичными и влекут за собой нарушение вентиляторной функции. В этих случаях в первые часы жизни уровень СО2 в конечной порции выдыхаемого воздуха был <4 об%. При сочетании двух этих причин, что имело место при развитии пневмонии у детей с синдромом дыхательных расстройств, уровень СО2 в конечной порции выдыхаемого воздуха был меньше 3,2 об% [48]. Как правило, у детей, относящихся к группе риска по развитию дыхательных расстройств, наблюдается поражение ЦНС гипоксического или инфекционно-токсического генеза, что особенно неблагоприятно сказывается на становлении функции внешнего дыхания у недоношенных детей. Мониторинг капнограммы позволяет по представленности различных типов капнограммы судить о тяжести поражения ЦНС ребенка. Кроме того, нами было показано, что у детей, имевших нарушения функции внешнего дыхания, градиент между концентрацией СО2 в конечной порции выдыхаемого воздуха и артериализованной капиллярной крови превышает 10 мм рт. ст. В тех же случаях, когда он был более 20 мм рт. ст., наблюдались тяжелые дыхательные расстройства, и уровень СО2 в конечной порции выдыхаемого воздуха всегда был меньше 3,2 об% [48]. Комплекс данных капнограммы: представленность типов капнограммы, уровень СО2 в конечной порции выдыхаемого воздуха и градиент между концентрацией СО2 в конечной порции выдыхаемого воздуха и артериализованной капиллярной крови позволяет уже через 30 мин после рождения выявить нарушение становления функции внешнего дыхания, предположить ведущий патофизиологический механизм и определить тактику оксигенотерапии [50]. Полученные данные легли в основу дифференцированного подхода к выбору сроков и методов оксигенотерапии и терапии сурфактантом. Так, мониторинг капнограммы у 159 новорожденных детей, у которых с первых часов жизни наблюдались нарушения функции внешнего дыхания, позволил выделить группу детей с преобладающим нарушением альвеолярной вентиляции. Применение экзогенного сурфактанта у этих детей (BL, Exosurf) оказалось более эффективным, чем в случае нарушения легочной гемодинамики [51].
Далее...
Написать комментарий
|

