|
Мосин В.А., Кругляк Е.Б., Стерлина Т.С., Корыстов Ю.Н., Шапошникова В.В., Кублик Л.Н., Левитман М.Х., Викторов А.В., Дриняев В.А. Научно-биологический центр "Фармбиомед", Москва
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 1999-N6, стр. 16-20.
В начало...
Авермектины - целевой продукт ферментации Streptomyces avermitilis, обладают паразитоцидной активностью и используются как действующее вещество инсектоакаронематоцидных препаратов. Изучали влияние природного авермектинового комплекса (аверсектина С) и индивидуальных авермектинов А1, А2, В1 и В2 на культуру клеток лимфолейкоза Р-388. Показано, что аверсектин С в концентрации 0,1-1,0 мкг/мл подавляет рост и вызывает гибель опухолевых клеток. Подавление роста обусловлено блокированием прохождения клеток по митотическому циклу. Гибель клеток сопровождается межнуклеосомной деградацией ДНК ядер, т.е. гибель происходит по типу апоптоза. Чувствительность клеток к аверсектину С прямо пропорциональна их исходной пролиферативной активности. Из индивидуальных авермектинов в использованном интервале концентраций цитотоксической активностью обладает только авермектин серии А1; авермектин серии А2 оказывает цитостатическое действие, а авермектины серии В1 не активны в этом отношении.Ключевые слова:
Авермектины - сходные по строению соединения макролидной природы, природным продуцентом которых является микроорганизм Streptomyces avermitilis. В глубинных условиях культивирования он продуцирует комплекс из 8 индивидуальных авермектинов [1]. Как авермектиновый комплекс в целом, так и индивидуальные авермектины обладают противопаразитарной активностью [1, 2], что сразу привлекло внимание исследователей и практических специалистов в области животноводства и растениеводства. Поскольку эта активность сильнее всего выражена у индивидуального авермектина В1а [1], на основе авермектинов группы В1 были созданы коммерческие сельскохозяйственные антипаразитарные препараты: абамектин, представляющий собой смесь из 80% авермектина В1а и 20% авермектина В1в и ивермектин - дигидрированное производное авермектина В1 [ 3,4 ].
Все последующие работы носили по преимуществу "прикладной" к антипаразитарному эффекту характер, касаясь механизмов летального для беспозвоночных и токсического для теплокровных действия авермектинов, экологических аспектов их применения и т.п. Этих работ - огромное количество, и создается впечатление, что авермектины изучены достаточно полно. Однако в действительности в подавляющем большинстве работ речь идет вовсе не об авермектинах в целом, а только об абамектине и ивермектине, т.е. компонентах авермектинового комплекса - авермектинах В1. Сведения о других авермектинах в литературе практически отсутствуют. Нам встретилась только одна работа, где показано, что авермектин В2 для некоторых нематод даже более токсичен, чем авермектин В1 [ 5 ].
Между тем природный авермектиновый комплекс, выделенный нами из сухой биомассы Streptomyces avermitilis и, названный "аверсектином С" [6], содержит все 8 индивидуальных авермектинов и обладает не только антипаразитарной активностью. В культуре тимоцитов крыс аверсектин С эффективно предотвращает апоптоз, индуцированный ионизирующим облучением или обработкой дексаметазоном, в то время как абамектин и ивермектин таким эффектом не обладают [7].
В предлагаемой работе мы изучали влияние аверсектина С на клетки также лимфоидного происхождения, на опухолевые - лимфолейкоза Р-388.
Клетки лимфолейкоза Р-388 выращивали в перитонеальной полости мышей самцов линии DBA/2. Прививали по 2?106 клеток, через 7 суток клетки (3?108-6?108) извлекали из брюшной полости, осаждали центрифугированием (400 об, 10 мин), ресуспендировали в растворе Хэнкса и снова осаждали. Отмытые клетки (106/мл) культивировали в инкубаторе с 5% СО2 при 37?С в среде RPMI-1640 с добавлением 10% телячьей сыворотки и 80 мкг/мл гентамицина в пластиковых чашках Петри (диаметр 3 см, объем суспензии 3 мл).
Аверсектин С и индивидуальные авермектины получали из сухой биомассы S. avermitilis [ 6 ]. Все действующие агенты добавляли одновременно с посевом клеток.
Концентрацию погибших клеток определяли по окраске 0,04% раствором трипанового синего. Выживаемость клеток определяли по формуле:
S = (С'v/Сv)?100% = (С't - C'd)/(Ct - Cd)?100%,
где Ct, Cv, Cd и C't, C'v, C'd - соответственно концентрации общая, живых и погибших клеток в контроле и опыте. Исходную пролиферативную активность определяли как увеличение числа клеток за 22 часа инкубации в контроле относительно их начального уровня, принятого за 100%. Распределение клеток по фазам митотического цикла и долю клеток с субдиплоидным набором ДНК (sub G1) определяли с помощью проточной цитометрии (100 кл/с). Клетки фиксировали 70% этанолом, переносили в фосфатный буфер (pH 7,2) и окрашивали реагентом Hoechst 33258 ("Serva") - 2 мкг/мл, 5 мин. Количество ДНК определяли по флуоресценции при 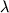 = 450 нм. В каждом опыте анализировали 50-100 тыс. клеток. При фиксации в этаноле из клеток выходят низкомолекулярные фрагменты ДНК [8], образующиеся при гибели клеток по типу апоптоза, поэтому такие клетки содержат ДНК меньше диплоидного количества (sub G1). Долю клеток с содержанием ДНК, соответствующим фазам митотического цикла, определяли из компьютерного анализа гистограмм по методу [9]. Типичные гистограммы распределения клеток по содержанию ДНК в контроле (А) и после воздействия аверсектина С (В) приведены на рис. 1. = 450 нм. В каждом опыте анализировали 50-100 тыс. клеток. При фиксации в этаноле из клеток выходят низкомолекулярные фрагменты ДНК [8], образующиеся при гибели клеток по типу апоптоза, поэтому такие клетки содержат ДНК меньше диплоидного количества (sub G1). Долю клеток с содержанием ДНК, соответствующим фазам митотического цикла, определяли из компьютерного анализа гистограмм по методу [9]. Типичные гистограммы распределения клеток по содержанию ДНК в контроле (А) и после воздействия аверсектина С (В) приведены на рис. 1.
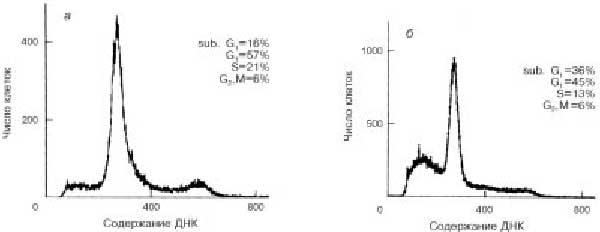 |
| Рис.1. Гистограммы распределения клеток Р-388 по содержанию ДНК в контроле (а) и после воздействия 0,3 мкг/мл аверсектина С (б) при длительности инкубации 22 часа. |
Для определения поврежденных ядер клетки фиксировали смесью Карнуа и затем окрашивали гематоксилином с эозином по Гимзе. Поврежденными считали ядра с конденсированным хроматином (пикноз) и с конденсированным хроматином, распавшимся на части (фрагментация). Подсчитывали 500-1000 клеток на каждый препарат при 600-кратном увеличении.
Одним из основных критериев апоптоза является межнуклеосомная фрагментация ДНК [10], выявляемая при ее электрофорезе. Электрофорез ДНК проводили в агарозном геле. ДНК выделяли по методу [11] с модификациями. Отмытые клетки (106) лизировали в растворе, содержащем 10 млмоль Tris-HCI pH 7,4, 1 млмоль ЭДTA и 1% SDS в течение 15 мин при комнатной температуре. Затем добавляли NaCl (конечная концентрация 1 М) и выдерживали 30 мин на холоду (4?С). Для очистки ДНК от белков к лизату добавляли равный объем фенола (рН 8,0). Смесь центрифугировали (1000 об, 5 мин). ДНК освобождали от солей, переосаждая в изопропаноле (в объеме, равном объему пробы), а затем в 80% этаноле. Осадок растворяли в 10 мкл Н2О и после добавления 2 мкл РНКазы (мг/мл) ("Sigma") инкубировали 1 час при 50?С. Затем образцы окрашивали бромфеноловым синим ("Serva"). ДНК разделяли в 1,8% агарозе в течение 2,5 час при U=5 В/см. После окраски этидиумбромидом гель фотографировали в ультрафиолете.
Для первоначальной общей оценки влияния на опухолевые клетки лимфоидного происхождения (лимфолейкоз Р-388) аверсектина С, авермектинов А1, А2, В1, В2 и ивермектина были выбраны концентрации 0,3-1,0 мкг/мл, поскольку именно в этих концентрациях аверсектин С предотвращал апоптоз нормальных лимфоидных клеток (тимоцитов) [7]. Обнаружено что все авермектины в этих концентрациях снижают выживаемость клеток, но наиболее активны аверсектин С и авермектин А1, эффекты других авермектинов статистически недостоверны (табл. 1).
| Таблица 1. Влияние авермектинов на выживаемость клеток лимфолейкоза Р-388 |
| Kонцентрация агента мкг/мл |
Аверсектин С |
Авермектин А1 |
Авермектин А2 |
Авермектин В1 |
Авермектин В2 |
Ивермектин |
| выживаемость клеток, % |
| 0,3 |
59 3 |
64 5 |
97 4 |
95 4 |
97 3 |
105 5 |
| 1,0 |
52 5 |
65 5 |
84 5 |
95 5 |
94 4 |
88 4 |
Примечание. Длительность инкубации 22 часа; n=6. За 100% принята выживаемость в контроле (без добавления авермектинов).
Далее...
Написать комментарий
|

