|
Калачева Н.В., Сергеева Е.В., Куриненко Б.М. Казанский государственный университет, кафедра микробиологии
В начало...
Изучено цитотоксическое действие на клетки панкреатической РНКазы, модифицированной поверхностно-активным веществом оксанолом КД-6 (ОксРНКаза). Цитотоксичность ОксРНКазы исследовалась in vitro и in vivo при витальном окрашивании клеток нейтральным красным и по включению 3Н-уридина, а также в тесте, отражающем влияние препарата на процесс слияния лизосом с фагосомами. Показано, что во всех использованных тестах гидрофобизированная РНКаза обладала более выраженным цитотоксическим действием, чем нативный фермент. На основании анализа экспериментальных данных высказано предположение, что цитотоксическое действие гидрофобизированной РНКазы обусловлено действием ее на мембранные структуры клетки, включая мембраны лизосом.Ключевые слова:
Введение в молекулы биологически активных веществ гидрофобного радикала может существенно повысить их сродство к клеточным мембранам и изменить биологическую активность препаратов, в том числе цитотоксичность [1]. Очевидно, что подобного рода модификация является перспективной для соединений, действующих на уровне цитоплазматической мембраны. Кроме того, в литературе имеются сведения о том, что связывание с гидрофобными реагентами приводит к усилению специфического биологического действия ряда веществ, обусловленного транслокацией их в клетку [2].
Основываясь на этих данных и используя в качестве объекта панкреатическую рибонуклеазу, мы модифицировали молекулу ферментного белка гидрофобным соединением оксанолом КД-6 и оценили некоторые показатели цитотоксической эффективности гидрофобизированного фермента. Результаты проведенных исследований представлены в данной работе.
В экспериментах использовали электрофоретически гомогенный препарат панкреатической рибонуклеазы. Активность фермента определяли по приросту кислоторастворимых продуктов при гидролизе им РНК [3]. Белок измеряли спектрофотометрически.
В качестве гидрофобного модификатора РНКазы использовали поверхностно-активное вещество - оксанол КД-6 производства Казанского завода "Оргсинтез", общей формулы СnH2n+1O(C2H4O)mH, где n = 8-10, а m = 6, которое предварительно переводили в альдегидную форму (оксаналь).
Модификацию РНКазы оксаналем осуществляли путем добавления его к 10 мг РНКазы, растворенной в 1 мл 0,1 М фосфатного буфера рН 7,6. Молярное соотношение РНКаза: оксаналь в процессе реакции равнялось 1:10. Гидрофобизированную РНКазу (ОксРНКаза) выделяли из реакционной смеси при помощи гидрофобной хроматографии на каприлцеллюлозе.
Расчет количества гидрофобных остатков, присоединенных к молекуле фермента, производили путем определения дефицита аминогрупп в модифицированном препарате по сравнению с нативным с помощью ТНБСК [4]. Используемый в работе препарат ОксРНКазы содержал 1 остаток оксанола на 1 моль ферментного белка.
Цитотоксическое действие гидрофобизированной РНКазы in vivo исследовали на беспородных мышах с суточной асцитной карциномой Эрлиха. Ферменты вводили внутрибрюшинно 1 раз в сутки в течение 7 дней. Торможение роста клеток опухоли вычисляли по формуле: А = [(К - О)/К]?100, где А - торможение роста клеток (%), К - средний объем клеток в асците контрольной группы животных, О - средний объем клеток в асците опытной группы животных. Каждую группу составляли 10 животных.
Цитотоксичность (СЕ50) РНКаз in vitro определяли с помощью теста прижизненного окрашивания нейтральным красным монослойной культуры линии опухолевых клеток СаОv по методике, описанной в работе [5], а также по включению 3Н-уридина в кислотонерастворимую фракцию клеточного материала следующим образом. Клетки линии СаОv инкубировали в ростовой среде при 37?С в специальных флаконах. Исходная концентрация составляла 3?105 клеток на флакон. Через 24 ч среду заменяли новой порцией (без сыворотки) с исследуемым препаратом. За 1 ч до окончания инкубации вносили 3Н-уридин (1 мкКи/мл), затем флаконы с клетками охлаждали до 0?С и обрабатывали, как описано в работе [6]. Радиоактивность измеряли на сцинтилляционном счетчике "Beta-1".
Влияние рибонуклеаз на слияние лизосом с фагосомами в перитонеальных макрофагах крыс проводили по методике Килиан и Кона [7]. Первичные культуры макрофагов получали из клеток перитонеальной жидкости, взятой у крыс в возрасте 5-6 недель. Клетки культивировали на покровных стеклах в среде 199 (рН 7,2), содержащей 100 мкг/мл канамицина. В качестве объекта фагоцитоза использовали свежие пекарские дрожжи Saccharomyces cerevisiae. Монослойные культуры макрофагов инкубировали в течение 30 мин при 37?С в растворе акридинового оранжевого (АО) в конечной концентрации 10 мкг/мл среды. После отмывки красителя раствором Хенкса клетки обрабатывали суспензией дрожжей в среде 199 в течение 20 мин. Затем клетки вновь отмывали от избытка дрожжей и после часовой инкубации при 37?С наблюдали фагоцитоз дрожжей макрофагами в люминесцентном микроскопе ЛЮМАМ И1 (Ленинградское оптико-механическое объединение). Присутствие окрашенных АО дрожжевых частиц внутри клеток указывает на слияние фагосом с лизосомами. В каждом случае определяли индекс слияния (в %) - число клеток, в которых произошло слияние фагосом с лизосомами на 100 просмотренных макрофагов. Опыты с каждым исследованным препаратом повторяли 5-6 раз.
Для изучения влияния исследуемых препаратов на процесс слияния фагосом с лизосомами макрофаги инкубировали с растворами этих соединений в среде 199 в соответствующих концентрациях в течение 2 ч при 37?С, отмывали раствором Хенкса, выдерживали 2 ч в среде культивирования при 37?С и затем подвергали окрашиванию АО.
Статистическую обработку результатов проводили с использованием t-критерия Стьюдента.
В табл. 1 приведены данные по цитотоксической активности ОксРНКазы, определенной in vivo в отношении асцитных клеток карциномы Эрлиха, из которых видно, что гидрофобизированная РНКаза намного эффективнее нативного фермента подавляет размножение опухолевых клеток. Усиление цитотоксичности РНКазы вследствие ее гидрофобизации не связано с цитотоксическим действием только остатков ПАВ. Это следует из того, что оксанол КД-6 в количестве, эквивалентном содержанию ПАВ в максимальной дозе ОксРНКазы, обладает значительно меньшим цитотоксическим эффектом.
| Таблица 1. Цитотоксическое действие гидрофобизированной и нативной РНКаз in vivo |
| Препарат |
Доза |
Kоличество асцитных клеток, см3 |
Торможение роста опухоли, % |
| мг/кг |
ед/кг |
| ОксРНKаза |
0,5 |
1500 |
0,4 0,2 |
89,1 |
| 0,1 |
300 |
1,9 0,6 |
48,6 |
| Нативная РНKаза |
0,5 |
150000 |
2,9 0,5 |
21,6 |
| 0,05 |
15000 |
3,8 0,7 |
Стимуляция |
| Оксанол |
0,03* |
|
2,8 0,3 |
22,0 |
| Kонтроль |
|
|
3,7 0,5 |
0 |
Примечание: * количество оксанола, эквивалентного его содержанию в дозе ОксРНКазы 0,5 мг/кг.
В следующих экспериментах была исследована цитотоксичность ОксРНКазы на опухолевых клетках САОv в тестах, отражающих преимущественное нарушение двух различных звеньев клеточного метаболизма. Тест прижизненного окрашивания клеток нейтральным красным связан с функционированием клеточных мембран, в том числе лизосом [8], а тест на включение 3Н-уридина в клетки характеризует процессы биосинтеза внутриклеточной РНК.
Из данных табл. 2 видно, что цитотоксичность ОксРНКазы по тесту поглощения клетками нейтрального красного в среднем в 12 раз выше цитотоксичности нативного фермента. В препарате ОксРНКазы, эквивалентном 1 СЕ50 содержится 1,6 мкг оксанола, что почти соответствует 1 СЕ50 исходного оксанола, использованного для модификации рибонуклеазы. Это можно рассматривать как доказательство того, что более высокая по сравнению с нативным ферментом цитотоксичность ОксРНКазы по данному показателю обусловлена наличием в препарате остатков оксанола.
| Таблица 2. Цитотоксичность гидрофобизированной и нативной РНКаз по тесту прижизненного окрашивания нейтральным красным опухолевых клеток СаОv |
| Препарат |
СЕ50, мкг/мл |
| ОксРНKаза |
24,0 4,1 |
| Нативная РНKаза |
290,0 49,3 |
| Оксанол |
1,4 0,24 |
Примечание: СЕ50 - доза фермента, вызывающая 50% подавление поглощения клетками витального красителя нейтрального красного.
Результаты экспериментов по включению 3Н-уридина в клетки САОv (табл. 3) свидетельствуют о том, что оксанол в дозе, эквивалентной содержанию ПАВ в препарате (1,6 мкг/мл) и в два раза большей (3,2 мкг/мл), не подавляет включение предшественника синтеза РНК в клетки. В связи с этим очевидно, что повышенная по сравнению с нативным ферментом способность ОксРНКазы подавлять включение 3Н-уридина в клетки является не суммированием свойств оксанола и РНКазы, а новым качеством фермента, связанным с его гидрофобизацией.
| Таблица 3. Подавление включения 3Н-уридина в клетки САОv гидрофобизированной и нативной РНКазами |
| Препарат |
Kонцентрация препарата, мкг/мл |
Подавление включения 3Н-уридина, % к контролю |
СЕ50, мкг/мл |
| ОксРНKаза |
24,0 |
51 3,1 |
24,0 2,2 |
| Нативная РНKаза |
290,0 |
38 4,3 |
376,0 25,2 |
| Оксанол |
1,6 |
0 |
|
| 3,2 |
0 |
| 16,0 |
12 4,0 |
| 32,0 |
26 2,7 |
Примечание: СЕ50 - доза фермента, вызывающая 50% подавление включения 3Н-уридина в клетки.
Если сравнить соотношения СЕ50 для нативной РНКазы и СЕ50 для ОксРНКазы в тестах поглощения клетками нейтрального красного и 3Н-уридина, то они равны соответственно 12,0 и 15,6. Столь незначительная разница между этими величинами не позволяет говорить о предпочтительном воздействии исследуемого препарата на биосинтез внутриклеточной РНК.
Теоретически гидрофобизированный фермент может проникнуть в клетку либо путем транслокации через плазматическую мембрану [2], либо посредством эндоцитоза с последующим поступлением в лизосомы. Транслокация ОксРНКазы в цитоплазму минуя лизосомы предполагает интенсивное подавление экзогенным ферментом биосинтеза внутриклеточной РНК по сравнению с другими тестами, что не соответствует полученным нами экспериментальным данным. Следовательно, наиболее вероятным остается эндоцитозный путь проникновения фермента в клетку. Так как в этом случае можно ожидать изменение функционирования лизосомного аппарата, нами было изучено влияние ОксРНКазы на процесс слияния лизосом с фагосомами. Исследования проводились на культуре перитонеальных макрофагов крысы. Результаты представлены на рисунке.
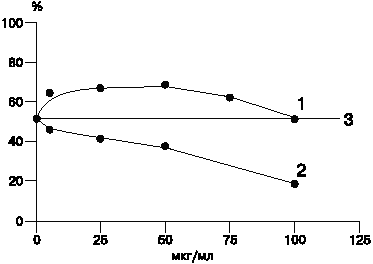 |
Влияние различных концентраций РНКаз на процесс слияния лизосом с фагосомами в макрофагах.
По оси абсцисс - концентрация РНКаз, мкг/мл;
по оси ординат - индекс слияния лизосом с фагосомами, %.
1 - нативная РНКаза;
2 - ОксРНКаза;
3 - контроль - соответствует индексу слияния лизосом с фагосомами в макрофагах, не обработанных ферментом.
На рисунке представлены средние данные 3-х экспериментов. Отклонение составляет 2%. |
Как следует из рисунка, нативная РНКаза в концентрации от 5 мкг/мл до 75 мкг/мл вызывает стимуляцию слияния фагосом с лизосомами. Доза 100 мкг/мл не оказывает влияния на этот процесс. Наблюдаемый эффект коррелирует с описанным в литературе стимулирующим действием низких концентраций РНКаз на фагоцитирующие клетки [9].
Что касается ОксРНКазы, то в отличие от нативного фермента, она обладает дозозависимой способностью подавлять слияние лизосом с фагосомами.
В литературе имеются сообщения о том, что ингибирование этого процесса рядом соединений происходит вследствие попадания последних в лизосомы и связано с конформационными перестройками в мембране лизосом, возникающими при их действии на мембрану [10].
Принимая во внимание это обстоятельство и анализируя представленные в работе экспериментальные данные, можно сделать следующее заключение. Во-первых, в результате связывания панкреатической РНКазы с поверхностно-активным веществом оксанолом КД-6 получен препарат, обладающий более выраженным цитотоксическим действием, чем нативный фермент. Во-вторых, ОксРНКаза, подобно нативному ферменту, попадает в лизосомы, т.е. проникает в клетку путем эндоцитоза. И наконец, усиление цитотоксических свойств гидрофобизированной РНКазы по сравнению с нативной, наблюдаемое во всех тестах, по-видимому, обусловлено ее действием на клеточные мембраны, включая мембраны лизосом, и повышенной тропностью препарата к этим структурам.
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 1998-N12, стр. 16-19.
1. Баренбойм Г.М., Маленков А.Г. Биологически активные вещества: новые принципы поиска. М 1986; 109-122.
2. Kabanov A.V., Levashov A.V., Alakhov V.Yu. et al. Biomed Sci 1990; 1: 1: 63-67.
3. Татарская Р.И., Абросимова-Амельянчик Н.М., Аксельрод В.Д. и др. Биохимия 1966; 5: 1017-1026.
4. Fields R. Biochem J 1971; 124: 283-290.
5. Finter W.B. J Gen Virol 1969; 9: 419-427.
6. Ершов Ф.И., Березина О.Н., Соколова Т.М. и др. Вопр вирусол 1973; 6: 743-746.
7. Kielian M., Cohn F.A. J Cell Ciol 1982; 93: 866-874.
8. Булычев А.Г. Цитология 1986; 28: 4: 387-402.
9. Куриненко Б.М., Нехорошкова З.М., Булгакова Р.Ш. Антибиотики и химиотер 1995; 7: 29-33.
10. Моженок Т.П., Булычев А.Г., Браун А.Д. Цитология 1990; 32: 9: 882-887.
Написать комментарий
|

