|
А.Н. Свердлова, М.Ш. Зарецкая, М.В. Нефелова Биологический факультет Московского государственного университета им. М.В. Ломоносова
В начало...
(Окончание)
Далее изучали градиентную экстракцию мицелия штамма S.griseolus 224 в режиме 20% водный этанол->80% водный этанол с более пологой линией градиента по сравнению с таковой для S.brunneofungus 118 (рис. 2). В данном случае спектрофотометрический контроль проводили только при max 314 нм, а пикратную реакцию - выборочно (в трех фракциях с наивысшей оптической плотностью для каждого пика). Знаки "+" и "-" над пиками означают способность образования экстрагируемыми веществами комплекса с пикратом аммония. Было выявлено пять основных пиков. Пикратные комплексы образуются только с продуктами первых четырех пиков. Из фракций, принадлежащих к этим пикам, при стоянии на холоду выпадали белые иглообразные кристаллы, которые отфильтровывали, подсушивали на воздухе и подвергали дальнейшей идентификации с помощью масс-спектров (табл. 2). Насколько надежны результаты анализа для лабильных природных объектов можно судить из двух повторных определений фракций N 23-25.
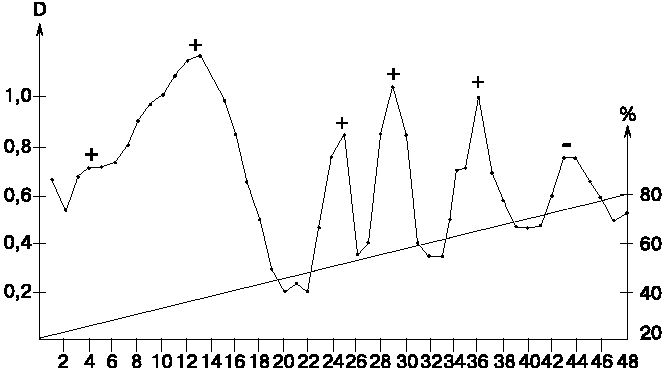 |
Рис. 2. Градиентная экстракция мицелия S.griseolus 224.
По оси абсцисс - фракция, N; по оси ординат (слева) - оптическая плотность, D, усл. ед.; по оси ординат (справа) - концентрация ацетона в экстрагенте, %. Знаки "+" и "-" над пиками означают наличие или отсутствие комплекса продукта с пикратом аммония. |
| Таблица 2. Масс-спектрометрический анализ экстрагируемых продуктов биосинтеза S.griseolus 224, полученных при градиентной экстракции мицелия в режиме 20% водный этанол->80% водный этанол и прямой ацетоновой экстракции |
| Фракция, N |
Kонцентрация ацетона, % |
Относительная интенсивность экстрагируемых веществ (усл.ед.) |
| Обнаруженные массовые числа (m/z), а.е. |
| 185 |
199 |
213 |
369 |
383 |
397 |
553 |
567 |
581 |
737 |
751 |
765 |
| 3-6 |
23-27 |
7,5 |
4,3 |
- |
7,5 |
5,1 |
0,5 |
1,9 |
1,4 |
0,4 |
0,6 |
0,9 |
0,3 |
| 10-18 |
32-43 |
6,6 |
5,5 |
0,3 |
6,0 |
7,5 |
0,3 |
1,7 |
2,1 |
0,7 |
0,4 |
1,8 |
1,0 |
| 23-25 |
49-51 |
7,0 |
6,5 |
0,4 |
6,7 |
7,5 |
0,5 |
2,0 |
2,9 |
1,2 |
0,5 |
2,7 |
1,5 |
| |
|
7,3 |
6,4 |
0,4 |
6,7 |
7,5 |
0,6 |
2,9 |
3,3 |
1,0 |
1,2 |
3,7 |
2,4 |
| 28-30 |
55-58 |
6,7 |
2,6 |
0,3 |
7,5 |
3,3 |
0,2 |
4,0 |
1,5 |
- |
2,5 |
2,1 |
0,2 |
| 34-38 |
63-68 |
6,7 |
0,6 |
0,2 |
7,5 |
0,6 |
- |
4,2 |
0,3 |
- |
2,9 |
0,3 |
- |
| Ацетоновая экстракция мицелия |
3,8 |
0,1 |
- |
1,5 |
- |
- |
0,7 |
- |
- |
7,5 |
0,9 |
- |
Во всех фракциях мы снова находим характерные для макротетролидов массовые числа, включая и тетрамерные фрагменты. Несмотря на хорошее разрешение пиков, исключая первый, разделение обнаруженных соединений нельзя считать удовлетворительным, хотя и наблюдается повышение относительного количества высших олигомеров с увеличением концентрации этанола. При этом интенсивность массовых чисел, принадлежащих мономерным и димерным соединениям, не снижается. Как и в случае S.brunneofungus 118, экстракция аммонийспецифичных продуктов из мицелия заканчивается примерно при 70% концентрации этанола. При дальнейшем увеличении концентрации спирта элюат оказывается оптически прозрачным. В то же время известно, что циклические антибиотики макротетролиды, особенно нонактин, являются достаточно гидрофобными соединениями и хорошо растворяются в ацетоне, этилацетате, хлороформе и значительно хуже даже в безводном этаноле (из которого его можно перекристаллизовать) [1, 8]. В водном этаноле нонактин практически нерастворим, следовательно, при описанном методе элюировались только линейные олигомеры нактиновых кислот.
Что же происходит при градиентной элюции мицелия? Действительно ли оба изучаемых штамма синтезируют только линейные олигомеры и не образуют циклических антибиотиков или последние в клетках продуцентов являются столь лабильными соединениями, что практически полностью подвергаются гидролизу в условиях градиентной экстракции? Присутствие во всех фракциях практически полного набора олигомеров независимо от концентрации этанола, а также наличие в спектрах поглощения четко выраженного плеча при max 314 нм скорее подтверждает второе предположение, для проверки которого мы провели два дополнительных эксперимента.
В первом случае стандартный препарат макротетролидов наносили на колонку с носителем из целлюлозы и подвергали ступенчатой градиентной экстракции водным ацетоном с последующим выделением веществ для масс-спектрометрического анализа. Из табл. 3 видно, что вымываемые с целлюлозы продукты представляют собой мономерные и димерные линейные олигомеры, как и в случае градиентной экстракции мицелия S.brunneofungus 118 водным ацетоном. Следовательно, макротетролиды и не только в клетке достаточно легко подвергаются гидролизу.
| Таблица 3. Масс-спектрометрический анализ продуктов при вымывании адсорбированных на целлюлозе макротетролидных антибиотиков с помощью ступенчатой градиентной элюции водно-ацетоновыми растворами |
| Элюент |
Относительная интенсивность элюируемых продуктов (усл.ед.) |
| Массовые числа (m/z), а.е. |
| 185 |
199 |
369 |
383 |
397 |
553 |
567 |
581 |
736 |
750 |
764 |
| Вода |
2,3 |
2,8 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
| 20% ацетон |
3,7 |
1,7 |
0,2 |
0,2 |
- |
- |
- |
- |
- |
- |
- |
| 40% ацетон |
4,2 |
3,7 |
2,6 |
2,0 |
0,5 |
0,6 |
0,1 |
0,2 |
0,6 |
0,1 |
0,2 |
| 60% ацетон |
1,0 |
1,0 |
1,8 |
1,4 |
- |
0,1 |
0,1 |
- |
- |
- |
- |
| 80% ацетон |
4,6 |
3,5 |
6,0 |
2,3 |
- |
1,2 |
0,7 |
- |
1,3 |
0,7 |
- |
| 100% ацетон |
2,4 |
0,8 |
5,2 |
4,7 |
- |
- |
- |
- |
- |
- |
- |
Во втором случае проводили обычное (не растянутое по времени и концентрации элюента, как в условиях градиентной экстракции) выделение продуктов биосинтеза S.griseolus 224 ацетоном. Для этого вначале мицелий отмывали от гидрофильных примесей клетки 50% водным ацетоном, а затем подвергали его экстракции ацетоном и очистке как описано в разделе "Материалы и методы". Получали иглообразное кристаллическое вещество с т. пл. 136-138?С. Масс-спектрометрический анализ (см. табл. 2, последняя строка) позволил идентифицировать массовые пики с m/z 737 и 751 а.е. как протонированные молекулярные ионы (М+Н+). В спектре имеются также характерные для фрагментации нонактина пики с m/z 553, 369 и 185 а.е. Среди гомологичных соединений заметно присутствие лишь монактина; соотношение циклических продуктов составляет 8,3:1 в пользу низшего гомолога нонактина. В ПМР-спектре исследуемого образца обнаружено пять групп хорошо выраженных сигналов: при 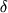 1,02-1,25; 1,4-2,1; 2,42; 3,08-4,05 и 4,9 м.д. с относительными интенсивностями 6:6:2:1:1. В УФ-спектре имеется один максимум при l 211 нм, в то время как для выделяемых при градиентной экстракции мицелия олигомеров нактиновых кислот характерно хорошо выраженное плечо при 1,02-1,25; 1,4-2,1; 2,42; 3,08-4,05 и 4,9 м.д. с относительными интенсивностями 6:6:2:1:1. В УФ-спектре имеется один максимум при l 211 нм, в то время как для выделяемых при градиентной экстракции мицелия олигомеров нактиновых кислот характерно хорошо выраженное плечо при 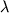 314 нм. Все эти данные хорошо совпадают с описанными в литературе для антибиотика нонактина [8]. 314 нм. Все эти данные хорошо совпадают с описанными в литературе для антибиотика нонактина [8].
Таким образом, выделенные из природных объектов стрептомицеты S.brunneofungus 118 и S.griseolus 224 синтезируют аммонийспецифичные продукты, принадлежащие к макротетролидным соединениям. С помощью градиентной экстракции мицелия продуцентов показано, что эти соединения являются достаточно лабильными как в нативных клетках, так и на синтетических носителях и подвергаются гидролизу водными растворами ацетона и этанола до различных линейных олигомеров нактиновых кислот. Ацетон стабилизирует, в основном, мономерные и димерные фрагменты, в то время как в этанольных экстрактах обнаруживается полный набор олигомеров от мономера до тетрамера. Метод градиентного экстрагирования суспензии целых клеток микроорганизмов может быть использован для изучения некоторых свойств, а также первичной идентификации биологически активных гидрофобных продуктов уже на ранних стадиях их извлечения.
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 1998-N7, стр. 7-11.
1. Овчинников Ю.А., Иванов В.Т., Шкроб А.М. Мембраноактивные компоненты. М 1974; 64-73.
2. Ando A., Oishi H., Hirano S. et al. J Antibiot 1971; 24: 347-352.
3. Goodfellow M., William S.T., Mogdarski M. Actinomycetes in Biotechnolog. San Diego 1988; 340-341.
4. Kuns D., Walker G., Wiesenberg I., Pfeilschifter J. Br J Pharmacol 1996; 7: 1621-1626.
5. Walker G., Kuz D., Pignat W. et al. Eur J Pharmacol 1996; 1/3: 265-270.
6. Свердлова А.Н., Нефелова М.В., Волкова И.В. и др. Мол генетика 1995; 4: 29-35.
7. Свердлова А.Н., Соловьева И.В., Нефелова М.В. Антибиотики и химиотер 1995; 4: 17-24.
8. Keller-Schierlein W., Gerlach H. Fortschr Chemie Organ Nat 1968; 26: 161-189.
9. Свердлова А.Н., Агбеноко К., Егоров Н.С. Антибиотики и химиотер 1995; 11: 3-9.
10. Fleck W.F., Ritzau M., Heinze S., Graefe U. J Basic Microbiol 1996; 4: 235-238.
Написать комментарий
|

