|
Принципы функционирования рибосом
А. С. СПИРИН
Московский государственный университет им. М.В. Ломоносова
ВВЕДЕНИЕ
Биосинтез белка имеет два аспекта: химический и генетический. Принципиальным
моментом является то, что в природе белок строится из аминокислот не посредством
их прямой конденсации с освобождением воды или одновременной полимеризации на
матрице, а путем последовательного добавления аминокислотных остатков к одному
из концов растущей полипептидной цепи (удлинения) с одновременным сканированием
матричного полинуклеотида (мРНК), задающего порядок добавления
различных аминокислотных остатков. Три последовательные химические реакции приводят
к включению (добавлению) аминокислоты в полипептидную
цепь строящегося белка:

Первая реакция - активация аминокислоты за счет образования ангидридной
связи между ее карбоксилом и фосфатом адениловой
кислоты - и вторая реакция - акцептирование аминоацильного
остатка молекулой тРНК с образованием сложноэфирной
связи между карбоксилом аминокислоты и гидроксилом концевого рибозного остатка
тРНК - происходят вне рибосомы, и обе реакции катализируется ферментом аминоацил-тРНК-синтетазой.
Третья реакция - транспептидация, то есть перенос карбоксильной
группы растущего полипептида от гидроксила рибозного остатка тРНК, принесшей
предыдущий аминокислотный остаток в цепь, на аминогруппу аминокислотного остатка
аминоацил-тРНК - осуществляется в рибосоме и катализируется самой рибосомой,
без постороннего фермента. Таким образом, именно молекулы аминоацил-тРНК являются
формой поступления аминокислотных остатков в рибосомы. Генетическая сторона
биосинтеза белка определяется тем, что поступление аминоацил-тРНК в рибосому
строго детерминировано матричной РНК (мРНК), являющейся копией гена, и порядок
чередования кодирующих триплетов (кодонов) вдоль цепи мРНК однозначно задает
структуру синтезируемого белка. Для этого рибосома сканирует цепь мРНК по триплетам
и последовательно выбирает из раствора аминоацил-тРНК с соответствующими аминокислотными
остатками, выбрасывая отработанные, деацилированные тРНК.
Итак, в процессе биосинтеза белка рибосома: а)?принимает кодированную генетическую
информацию от ДНК в виде мРНК и расшифровывает ее, б) катализирует образование
пептидных связей в реакции транспептидации и в) передвигает цепь мРНК и молекулы
тРНК. Таким образом, рибосома - сложная белоксинтезирующая частица, обладающая
одновременно генетической (декодирующее устройство), энзиматической (рибосома
как фермент пептидилтрансфераза) и механической (молекулярная машина) функциями.
Очевидно, что эти функции базируются на специфической структуре рибосомы как
рибонуклеопротеидной частицы. Принципы структуры рибосомы были рассмотрены в
предыдущей статье [1]. Эта статья - попытка сформулировать принципы функционирования
рибосомы на основании наших знаний о структурных особенностях рибосомы и ее
функциональных проявлениях.
ПРИНЦИП N 1: РАЗДЕЛЕНИЕ ДЕКОДИРУЮЩЕЙ И ЭНЗИМАТИЧЕСКОЙ ФУНКЦИЙ МЕЖДУ СУБЧАСТИЦАМИ
Трансляция начинается с того, что мРНК, синтезируемая на ДНК
в качестве копии одной из двух цепей последней, связывается с рибосомной частицей.
При этом рибосомная частица (у прокариот прямо и непосредственно,
а у эукариот после некоторого скольжения вдоль некодирующей
части мРНК) специфически взаимодействует с началом кодирующей нуклеотидной последовательности
мРНК. Этап связывания мРНК с рибосомной частицей и нескольких последующих событий,
приводящих к образованию первой пептидной связи, называется инициацией трансляции.
Вслед за инициацией рибосома последовательно "читает" цепочку мРНК по тройкам
(триплетам) нуклеотидов по направлению к 3'-концу, наращивая
(удлиняя) полипептидную цепочку аминокислотными остатками; этот этап собственно
трансляции называется элонгацией. Наконец, достигнув специального
нуклеотидного триплета - стоп-кодона, или кодона терминации,
- рибосома освобождает синтезированную полипептидную цепочку
белка: происходит терминация трансляции. Эпицикл трансляции, включающий инициацию,
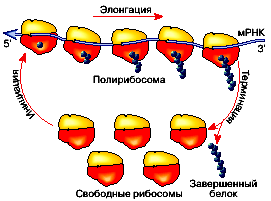
элонгацию и терминацию, схематически представлен на рис. 1.
|
Рис. 1. Эпицикл трансляции: 1) свободная рибосомная частица ассоциирует
с мРНК у начала ее кодирующей последовательности нуклеотидов и начинает
трансляцию на специальном инициирующем кодоне, с участием специальной инициаторной
тРНК (инициация трансляции); 2) затем считывает кодирующую последовательность
нуклеотидов по триплетам (кодонам) в направлении от 5'-конца к 3'-концу
и соответственно наращивает полипептидную цепь по одной аминокислоте, последовательно
удлиняя ее С-конец (элонгация); 3) и, дойдя до специального стоп-триплета
(терминирующего кодона), прекращает трансляцию и освобождает законченную
полипептидную цепь белка (терминация трансляции). Рибосомные частицы, закончившие
трансляцию и диссоциировавшие от мРНК, снова готовы инициировать трансляцию
и войти в эпицикл.
После инициации, двигаясь по цепи мРНК, рибосома все больше отодвигается
от 5'-конца, и в результате ранее занимаемый ею отрезок мРНК становится
свободным и способным связывать другую рибосому. Эта вторая рибосома тоже
начинает трансляцию и двигается вслед за первой рибосомой, отодвигается
от 5'-концевого отрезка и дает возможность третьей рибосоме сесть на мРНК
и начать трансляцию и т.д. Таким путем, двигаясь вдоль мРНК друг за другом,
несколько рибосом одновременно считывают одну и ту же запись и, следовательно,
синтезируют идентичные полипептидные цепи (разумеется, в каждый данный момент
полипептидные цепи на разных рибосомах находятся на разной стадии завершенности
- чем ближе к 3'-концу мРНК, тем завершеннее). Такая структура, в которой
одна мРНК ассоциирована со многими рибосомами, ее одновременно транслирующими,
называется полирибосомой |
Генетические функции малой рибосомной субчастицы
Характерным моментом инициации трансляции является то, что на этом этапе участвуют
не целые рибосомы, а их отдельные субчастицы. Другими словами, для того чтобы
инициировать трансляцию, рибосома должна быть диссоциирована на две составляющие
ее неравные субчастицы. Для этого клетка располагает специальными механизмами,
обеспечивающими диссоциацию рибосом после терминации трансляции. Именно малая
субчастица рибосомы (30S у прокариот и 40S у эукариот), и только она, связывается
с мРНК, то есть служит первичным приемником генетической информации для белоксинтезирующего
аппарата. Лишь впоследствии, при завершении этапа инициации трансляции, к ней
присоединяется большая субчастица (50S у прокариот и 60S у эукариот), образуя
полную рибосомную частицу (70S у прокариот и 80S у эукариот), которая и будет
производить элонгацию.
В процессе элонгации рибосома удерживает мРНК и движется относительно ее (или
протягивает ее сквозь себя) в направлении от 5'-конца к 3'-концу. Удержание
мРНК на рибосоме есть целиком и полностью функция малой рибосомной субчастицы,
в то время как большая субчастица с мРНК никак не взаимодействует. Соответственно
последовательное сканирование кодирующей последовательности мРНК (считывание
генетической информации) в ходе элонгации осуществляется на малой субчастице
транслирующей рибосомы.
Механизм потриплетного сканирования мРНК в ходе элонгации предполагает участие
молекул тРНК, которые взаимодействуют прежде всего с малой рибосомной субчастицей.
Малая субчастица в составе полной транслирующей рибосомы имеет два тРНК-связывающих
участка, обозначаемых как аминоацил-тРНК-связывающий участок (А-участок) и пептидил-тРНК-связывающий
участок (Р-участок). На этапе элонгации Р-участок всегда занят остатком тРНК.
Рассмотрение элементарного акта элонгации удобно начать с момента, когда Р-участок
занят молекулой пептидил-тРНК (тРНК, несущая растущую полипептидную цепь), а
А-участок вакантен и содержит лишь некий нуклеотидный триплет (кодон) мРНК,
пока не взаимодействующий ни с каким триплетом (антикодоном) тРНК (рис. 2, состояние
I). Такая рибосома готова (компетентна) связать аминоацил-тРНК, антикодон которой
комплементарен триплету (кодону), установленному в А-участке. При наличии около
рибосомы такой аминоацил-тРНК происходит первый шаг элементарного элонгационного
цикла - кодонспецифическое связывание аминоацил-тРНК с А-участком. Теперь рибосома
несет "старую" пептидил-тРНК в Р-участке и новоявленную аминоацил-тРНК в А-участке,
которые расположены рядом, бок о бок (рис. 2, состояние II ). Следовательно,
в результате кодон-антикодонового взаимодействия мРНК с тРНК на малой субчастице
рибосомы произошло декодирование триплета мРНК: именно тот аминокислотный остаток,
который был привешен к тРНК с комплементарным антикодоном, оказался в рибосоме.
Далее молекулы пептидил-тРНК и аминоацил-тРНК, расположенные рядом в рибосоме,
реагируют друг с другом: пептидильный остаток переносится на аминогруппу молекулы
аминоацил-тРНК. Это второй шаг элементарного элонгационного цикла - транспептидация,
когда полипептидная цепь удлиняется на одну аминокислоту - на ту, которую принесла
тРНК, связавшаяся с А-участком. А сама тРНК, принесшая эту аминокислоту, так
и осталась с ней связанной и, таким образом, связанной с удлиненным полипептидом
(рис. 2, состояние III). В этом состоянии, однако, новообразованная пептидил-тРНК
- точнее, ее остаток тРНК - занимает "не положенный ей" А-участок, а "сидит"
в Р-участке деацилированная (без пептидильного или аминоацильного остатков)
тРНК. Такое состояние называется претранслокационным. Дальше элонгация идти
не может, пока не осуществится третий шаг элонгационного цикла - транслокация,
которая выбросит деацилированную тРНК из Р-участка и переведет пептидил-тРНК
из А-участка в Р-участок вместе со связанным с ней кодоном мРНК. В результате
в освободившемся А-участке на малой рибосомной субчастице установится следующий
(новый) кодон мРНК. Цикл завершился, приведя к образованию одной пептидной связи
и соответствующему удлинению растущего полипептида на одну аминокислоту, с одной
стороны, и к прочтению одного кодона мРНК и перемещению мРНК на один триплет
- с другой. Повторение таких элементарных циклов и создает процесс элонгации.

|
Рис. 2. Элементарный элонгационный цикл рибосомы, в результате которого
прочитывается один триплет (кодон) мРНК
и образуется одна пептидная связь (добавляется одна аминокислота к растущему
полипептиду).
В каждый данный момент в ходе элонгации рибосома сидит на участке кодирующей
последовательности мРНК и удерживает молекулу пептидил-тРНК.
Пептидил-тРНК есть растущая полипептидная цепь, ковалентно присоединенная
своим С-концом к тРНК, которая и принесла последний (С-концевой) аминокислотный
остаток растущему пептиду. Когда пептидил-тРНК занимает Р-участок рибосомы
(состояние I ), рибосома может связывать молекулу аминоацил-тРНК,
соответствующую кодону, установленному на данный момент в А-участке (шаг
1 ). В результате удерживаемая рибосомой пептидил-тРНК и вновь связанная
аминоацил-тРНК оказываются в рибосоме бок о бок (состояние II ). Рибосома
(ее пептидилтрансферазный центр на большой субчастице) катализирует реакцию
транспептидации между этими двумя субстратами рибосомы - пептидил-тРНК и
аминоацил-тРНК: пептидильный остаток переносится от "своей" тРНК на аминогруппу
аминоацил-тРНК, тем самым удлиняясь на одну аминокислоту на С-конце (шаг
2 ). Теперь в Р-участке осталась деацилированная тРНК, а в А-участке помещается
остаток тРНК удлиненной пептидил-тРНК (состояние III ). Следующий за этим
акт транслокации состоит в том, что деацилированная тРНК выталкивается из
Р-участка, а пептидил-тРНК (ее остаток тРНК) перемещается вместе со связанным
с ней кодоном мРНК из А-участка в Р-участок (шаг 3 ). В итоге А-участок
освобождается, и в нем устанавливается следующий кодон мРНК. Цикл завершился.
Повторение таких циклов по числу кодонов мРНК создает полный процесс элонгации.
Следует отметить, что шаг 1 (связывание аминоацил-тРНК) катализируется белком
- фактором элонгации EF1 - с участием ГТФ, а шаг 3 (транслокация)
- другим белком - фактором элонгации EF2 - и тоже с участием ГТФ. В ходе
катализа ГТФ расщепляется (гидролизуется) до ГДФ и ортофосфата |
Таким образом, малая рибосомная субчастица в изолированном состоянии воспринимает
копию гена в форме мРНК и инициирует процесс ее трансляции, а в ходе трансляции
малая субчастица полной рибосомы удерживает мРНК на себе, декодирует ее с помощью
тРНК и последовательно перебирает ее кодоны и тРНК, используя механизм транслокации.
Так как все это операции с генетическим материалом, то указанные функции малой
рибосомной субчастицы могут быть определены как генетические.

|
| Рис. 3. Реакция транспептидации, катализируемая пептидилтрансферазным
центром большой рибосомной субчастицы |
Энзиматические функции большой рибосомной субчастицы
Когда пептидил-тРНК занимает Р-участок, а аминоацил-тРНК - А-участок на малой
субчастице рибосомы (см. рис. 2,
состояние II) , концы остатков тРНК с присоединенными к ним аминоацильными остатками
взаимодействуют с большой субчастицей рибосомы. Участок этого взаимодействия
на большой субчастице является пептидилтрансферазным центром рибосомы: он катализирует
реакцию транспептидации между пептидил-тРНК и аминоацил-тРНК, то есть перенос
карбоксильной группы пептидильного остатка на аминогруппу аминоацил-тРНК (рис.
3). В результате образуется новая пептидная связь, и пептидильный остаток становится
на одну аминокислоту длиннее. Таким образом, большая субчастица транслирующей
рибосомы выступает здесь как фермент, ответственный за образование пептидных
связей и в целом за синтез (элонгацию) полипептидной цепи. Это главная энзиматическая
функция рибосомы.
Следует отметить, что никакого отдельного от рибосомы белка-фермента, катализирующего
образование пептидных связей на рибосоме, не существует. Не найдено и никакого
специального белка в составе рибосомы, который бы обладал такой энзиматической
функцией. Транспептидация катализируется пептидилтрансферазным центром самой
рибосомы как интегральной частью большой рибосомной субчастицы, и основной вклад
в организацию центра вносит, по-видимому, рибосомная РНК субчастицы.
Кроме катализа реакции транспептидации большая рибосомная субчастица определенным
образом участвует в энзиматическом расщеплении (гидролизе) гаунозинтрифосфата
(ГТФ) в процессе трансляции. Дело в том, что, как видно на рис. 2, первый и
третий шаги элонгационного цикла идут с участием специальных нерибосомных белков
- так называемых факторов элонгации EF1 и EF2. Эти белки являются катализаторами
соответствующих нековалентных переходов - связывания аминоацил-тРНК и транслокации.
Для такого катализа необходимым оказывается сопряженный гидролиз ГТФ. Именно
большая рибосомная субчастица взаимодействует с факторами элонгации и индуцирует
гидролиз ГТФ на них. Хотя сам ГТФазный центр находится не на рибосомной субчастице,
а на белке - факторе элогнации, ее временная ассоциация с фактором
существенна для формирования активного энзиматического ГТФазного центра.
Таким образом, существует четкое разделение труда между двумя неравными субчастицами
рибосомы: малая субчастица выполняет генетические функции, будучи ответственной
за прием и декодирование генетической информации, в то время как большая участвует
в энзиматических реакциях в процессе трансляции. Схематическое изображение "разъятой"
рибосомы с распределением ее основных функциональных центров на двух субчастицах
дано на рис. 4.

|
| Рис. 4. Расположение функциональных центров на малой (вверху) и большой
(внизу) субчастицах рибосомы. Цепь мРНК связана с малой субчастицей в районе
ее "шеи" и протягивается через этот мРНК-связывающий центр в ходе трансляции
от 5'-конца (направлен вниз и вправо) к 3'-концу (обращен вверх и влево).
Две молекулы тРНК занимают А- и Р-участки на малой субчастице, будучи связаны
своими антикодонами с двумя смежными кодонами мРНК в районе "шеи" малой
субчастицы. Пептидилтрансферазный центр (РТС ) расположен в районе "шеи"
(в борозде под центральным выступом) большой субчастицы. Когда субчастицы
ассоциированы, акцепторные концы двух тРНК с их аминоацильным и пептидильным
остатками взаимодействуют с пептидилтрансферазным центром большой субчастицы.
Факторы элонгации EF1 и EF2 связываются в районе палочкообразного бокового
выступа большой субчастицы (на рисунке направлен на зрителя) со стороны,
обращенной к малой субчастице |
Далее...
Написать комментарий
|

