|
Богуш Т.А., Смирнова Г.Б., Богуш Е.А., Ж. Робер Онкологический научный центр им. Н.Н.Блохина РАМН, Москва
В начало...
Разработан новый метод прижизненной оценки функциональной активности транспортеров, выбрасывающих противоопухолевые препараты из клеток, в образцах интактных солидных опухолей. В основу нового метода положен общепринятый подход к функциональной оценке транспортеров по уровню внутриклеточного накопления противоопухолевых препаратов, в частности, антрациклинового антибиотика доксорубицина. Существенным отличием, позволившим исследовать интактные образцы солидных опухолей и значительно упростившим исследование, является то, что внутритканевое и внутриклеточное накопление доксорубицина в исследуемом образце определяется не по содержанию препарата, а по его убыли в среде инкубации с образцом опухоли. При этом для вычленения именно внутриклеточного содержания доксорубицина и оценки функциональной активности транспортеров в процесс исследования включено изучение влияния на убыль препарата из среды инкубации ингибиторов мембранных транспортеров - верапамила (ингибитор P-gp) и азида натрия (ингибитор всех энергетически зависимых транспортеров АВС семейства). Правомочность такого методического подхода была подтверждена в экспериментах с образцами солидного рака Эрлиха, трансплантируемого на мышах (чувствительный вариант опухоли и опухоль с индуцированной множественной лекарственной резистентностью). С помощью разработанного метода при исследовании биопсийных образцов злокачественных опухолей молочной железы человека выявлена функциональная активность разных транспортеров цитостатиков: 1) только P-gp; 2) P-gp и других транспортеров АВС семейства; 3) только транспортеров, отличных от P-gp; 4) отсутствие функциональной активности транспортеров цитостатиков. Сформулированы основные направления дальнейших исследований функциональной активности транспортеров цитостатиков в солидных опухолях человека, которые впервые становятся возможными при использовании разработанного метода.Ключевые слова:
Одной из причин, снижающих эффективность противоопухолевой химиотерапии, является экспрессия мембранных транспортеров, выбрасывающих цитостатики из клеток, и таким образом снижающих их внутриклеточное содержание, что, в свою очередь, приводит к развитию резистентности ко многим лекарствам - так называемой множественной лекарственной резистентности (МЛР). В настоящее время идентифицированы три транспортных белка: P-гликопротеин (P-gp) [1], белок, ассоциированный с МЛР (MRP) [2-4], и белок, ассоциированный с раком легкого (LRP) [5], которые являются представителями большого семейства мембранных энергетически зависимых транспортеров (так называемое АВС семейство транспортеров) [6].
Физиологическая роль большинства представителей АВС транспортеров не изучена и признанным индикатором МЛР является P-gp. Экспрессия этого транспортера в ряде случаев коррелирует с чувствительностью к противоопухолевой химиотерапии, длительностью безрецидивного течения заболевания и его благоприятным прогнозом [7-12]. Однако частое отсутствие такой корреляции привело к заключению о необходимости оценки функциональной активности экспрессированного P-gp. Разработанные методы позволяют проводить такую оценку в опухолевых клетках, находящихся в суспензии, и поэтому широко используются при изучении разных форм лейкоза [13-15]. Надо отметить, что во многих случаях такой функциональный тест позволяет с большей вероятностью прогнозировать эффективность противоопухолевой химиотерапии и течение заболевания [4,7]. Что касается солидных опухолей, которые составляют основную долю онкологических заболеваний, то проведение подобной оценки, строго говоря, невозможно. Применение даже самых "мягких" методов получения суспензии клеток из плотной ткани неизбежно приводит к неконтролируемому повреждению клеток, что, в свою очередь, искажает результаты тестирования функциональной активности мембранных транспортеров. По мнению ведущих исследователей МЛР, именно отсутствие методов определения функциональной активности транспортеров цитостатиков в солидных опухолях препятствует прогрессу изучения МЛР и разработке методов ее преодоления [15]. Мы полностью разделяем эту точку зрения.
Учитывая сказанное, основной задачей нашего исследования явилась разработка нового метода прижизненной оценки функциональной активности обратного транспорта цитостатиков из клеток в образцах интактных опухолей с использованием ингибиторов этого процесса.
Исследования проведены на образцах чувствительного и резистентного вариантов солидной формы рака Эрлиха, трансплантируемого подкожно у мышей линии F1, а также на образцах солидных опухолей человека, полученных во время хирургических операций.
В работе использован противоопухолевый антрациклиновый антибиотик доксорубицин (10-6 М, "Farmacia"), специфический ингибитор Р-гликопротеина - верапамил (2x10-4 М, "Lek") и ингибитор всех энергетически зависимых процессов в клетках - азид натрия (5x10-3 М, "Sigma").
Измерения флуоресценции доксорубицина проводили на спектрофлуориметре "Hitachi F 2000" при длине волны возбуждения 470 нм и длине волны флуоресценции 590 нм.
Доксорубицин растворяли в 0,9% растворе хлорида натрия до концентрации 10-4 М и добавляли в спектрофлуориметрическую кварцевую кювету в объеме 10 мкл на 1 мл среды инкубации. Средой инкубации (рН 7,4) служил раствор Хенкса без фенолового красного ("ПанЭко", Москва) с добавлением 10 мМ буфера Hepes ("Sigma").
Оценку внутриклеточного накопления доксорубицина в клетках монослойной культуры клеток аденокарциномы молочной железы человека MCF-7 doxR проводили спектрофлуориметрическим методом, описанным ранее [16-18].
Статистическую обработку результатов проводили методом Фишера-Стьюдента.
В основу разрабатываемого подхода положен общепринятый метод оценки функциональной активности P-gp по уровню внутриклеточного накопления противоопухолевых препаратов, выброс которых из клеток осуществляется этим мембранным транспортером, в частности, антрациклинового антибиотика доксорубицина. Существенным отличием, позволившим проводить изучение интактных образцов солидных опухолей и значительно упростившим исследование, является то, что внутритканевое и внутриклеточное накопление доксорубицина в исследуемом образце определяли не по содержанию препарата в ткани, а по его убыли в среде инкубации с образцом опухоли. При этом для вычленения именно обратного транспорта доксорубицина из клеток в процесс исследования включена оценка воздействия на убыль препарата из среды инкубации ингибиторов мембранных транспортеров, которые не влияют на внутритканевую и внутриклеточную диффузию антибиотика. Схематически методика исследования изображена на рис. 1.
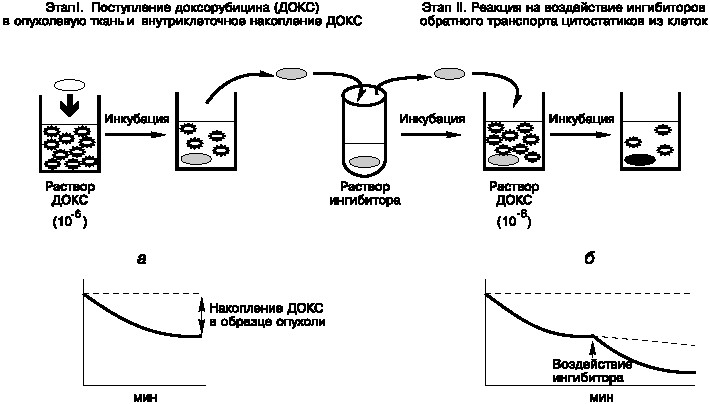 |
Рис. 1. Схема проведения оценки функциональной активности мембранных транспортеров цитостатиков в интактных образцах опухолей.
 - интенсивность флуоресценции ДОКС; - интенсивность флуоресценции ДОКС;  - образец опухоли во время инкубации с ДОКС. - образец опухоли во время инкубации с ДОКС.
На графиках а и б по оси абсцисс: время инкубации, по оси ординат - уменьшение флуоресценции ДОКС (интегральный показатель). |
На I этапе (см. рис. 1) образец опухоли помещается в кварцевую флуориметрическую кювету в раствор доксорубицина в концентрации 10-6 М с измеренной величиной флуоресценции антрациклина. На протяжении 15-20 мин инкубации кусочек опухоли (3x3x3 мм) через каждые 5 мин на короткое время вынимается из кюветы и регистрируется оставшаяся в растворе флуоресценция доксорубицина. Суммарная убыль флуоресценции по окончании инкубации характеризует интегральный показатель - уровень внутритканевого и внутриклеточного накопления препарата (см. рис. 1, а).
На II этапе исследования (см. рис. 1) вычленяется внутриклеточный обратный транспорт доксорубицина при оценке влияния ингибиторов мембранных транспортеров цитостатиков на скорость убыли флуоресценции антибиотика из среды инкубации. Чтобы избежать возможное взаимодействие доксорубицина с ингибитором, кусочек опухоли переносится из кюветы в пробирку с раствором исследуемого ингибитора (в контроле - в пробирку с раствором Хенкса) и инкубируется с ним при 37?С в течение 20 мин, после чего опухоль вновь помещается в спектрофлуориметрическую кювету с известной величиной флуоресценции раствора доксорубицина и повторяется оценка кинетики убыли препарата из среды инкубации, как на I этапе исследования. При отсутствии в клетках функционально активных транспортеров цитостатиков внутриклеточное накопление доксорубицина остается неизменным (по сравнению с контролем) и скорость убыли флуоресценции из среды инкубации не изменяется. В том случае, если в клетках исследуемого образца опухоли экспрессированы функционально активные транспортеры цитостатиков, скорость уменьшения флуоресценции доксорубицина в среде инкубации в результате повышения именно внутриклеточного накопления антибиотика увеличивается по сравнению с контролем (см. рис. 1, б). Эффект исследуемого ингибитора транспортеров цитостатиков оценивается по изменению скорости убыли флуоресценции доксорубицина в среде инкубации в течение 5 мин до и после воздействия ингибитора по сравнению с аналогичным показателем в контроле. При этом следует отметить, что оценка эта строго количественная, так как измерения проводятся в одном и том же образце опухоли, что полностью исключает погрешность за счет возможных различий в размере исследуемого кусочка опухоли. По существу, в этих условиях эксперимента величина исследуемого кусочка опухоли не влияет на результат.
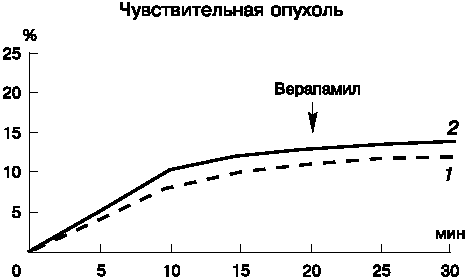
Правомочность такого методического подхода первоначально была подтверждена нами в экспериментах с образцами солидного варианта рака Эрлиха, трансплантируемого на мышах. Данные, представленные на рис. 2, демонстрируют влияние специфического ингибитора P-gp верапамила на внутриклеточное накопление доксорубицина в чувствительной опухоли и в опухоли с индуцированной МРЛ. Видно, что именно в резистентной опухоли отмечается увеличение скорости внутриклеточного накопления доксорубицина (приблизительно в 3 раза по сравнению с контролем) после воздействия верапамила, что свидетельствует об экспрессии функционально активного транспортера P-gp. В чувствительном варианте опухоли, как и следовало ожидать, влияния ингибитора на скорость внутриклеточного накопления доксорубицина не выявлено, что согласуется с представлением об отсутствии в таких опухолях экспрессии P-gp.
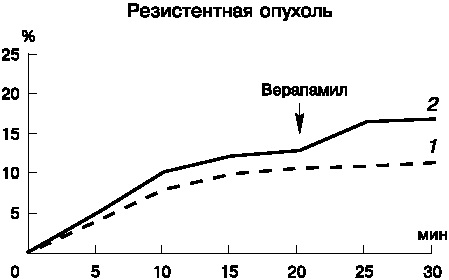 |
Рис. 2. Влияние верапамила на внутриклеточное накопление доксорубицина (ДОКС) в клетках солидного варианта рака Эрлиха при концентрации ДОКС во всех экспериментах - 10-6 М.
По оси абсцисс - время инкубации с ДОКС, по оси ординат - уменьшение флуоресценции ДОКС (в % к исходной)
1 - контроль, 2 - верапамил 2x10-4 М. |
 |
В дальнейших экспериментах, проведенных с использованием разработанного метода на образцах опухолей человека, полученных во время хирургических операций, были использованы два ингибитора транспортеров цитостатиков. Во-первых, как и в предыдущих экспериментах, верапамил -специфический ингибитор P-gp. Во-вторых, азид натрия - ингибитор всех энергетически зависимых (АТФ-зависимых) процессов в клетках и как следствие - всех энергетически зависимых транспортеров цитостатиков семейства АВС (в том числе и P-gp). Включив в исследование азид натрия, мы продемонстрировали возможность оценки на одном и том же небольшом образце опухоли эффективности нескольких модификаторов, число которых ограничивается лишь размером доступной для исследования опухолевой ткани. Кроме того, задача сводилась к тому, чтобы оценить наличие других, отличных от P-gp, функционально активных мембранных транспортеров цитостатиков в солидных опухолях человека. По нашему мнению, подтверждением этого могли бы служить случаи более выраженного увеличения внутриклеточного накопления доксорубицина при воздействии азида натрия, по сравнению с воздействием верапамила, либо наличие эффекта азида натрия при отсутствии эффекта верапамила.
Далее...
Написать комментарий
|

