|
С.М. Елизаров, Т.А. Мичурина, В.Н. Даниленко. Институт биохимии им. А.Н. Баха РАН, Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов, Москва.
В начало...
Экстракты клеток Streptomyces lividans, полученные при физиологической ионной силе из культур на ранней логарифмической стадии роста, проявляют эндогенную протеинкиназную активность. Инкубация солерастворимых белков S.lividans с [ -32Р]АТР ведет к включению радиоактивного фосфата в 6-7 полипептидных цепей с молекулярной массой 12-100 кДа. Добавление гепарина, полилизина, спермина, фосфатидилсерина, канамицина, сАМР и сGMP не влияет на спектр и глубину фосфорилирования полипептидов в экстракте, тогда как ионы Са2+ стимулируют фосфорилирование белков в экстракте. Показано, что исследуемая протеинкиназа (или протеинкиназы) катализирует присоединение фосфатных групп к сериновым и треониновым остаткам в полипептидах с молекулярной массой 100 кДа и 35 кДа. -32Р]АТР ведет к включению радиоактивного фосфата в 6-7 полипептидных цепей с молекулярной массой 12-100 кДа. Добавление гепарина, полилизина, спермина, фосфатидилсерина, канамицина, сАМР и сGMP не влияет на спектр и глубину фосфорилирования полипептидов в экстракте, тогда как ионы Са2+ стимулируют фосфорилирование белков в экстракте. Показано, что исследуемая протеинкиназа (или протеинкиназы) катализирует присоединение фосфатных групп к сериновым и треониновым остаткам в полипептидах с молекулярной массой 100 кДа и 35 кДа.Ключевые слова:
Представители рода Streptomyces являются грамположительными филаментными почвенными микроорганизмами, способными подвергаться сложной морфологической дифференциации с образованием таких специализированных структур, как субстратный и воздушный мицелии и споры [1]. Параллельно и интегрированно с морфологической дифференциацией происходит процесс биосинтеза вторичных метаболитов, включая антибиотики [2]. Важную роль в дифференциации, в регуляции биосинтеза вторичных метаболитов и во взаимосвязи этих процессов приписывают различным сигнал-трансдуцирующим системам, включая фосфорилирование белков протеинкиназами [3, 4]. Установлено, что в прокариотах главными субстратами фосфорилирования в белках являются остатки His и Asp [5], тогда как в эукариотах - остатки Tyr, а также Ser и Thr [6, 7]. Соответственно, протеинкиназы могут быть подразделены на два больших сверхсемейства: His-протеинкиназы (на остатки Asp фосфат переносится с остатков His без участия ATP) и Ser/Thr- и Tyr-протеинкиназы. Основанием для такой классификации является как субстратная специфичность ферментов, так и сходство последовательностей аминокислот в пределах каждого из сверхсемейств [5-7]. His/Asp-протеинкиназная система была обнаружена недавно также и в клетках эукариот [8]. Участие Tyr- и Ser/Thr-протеинкиназ в фосфорилировании эндогенных белков было продемонстрировано в последнее время и у бактерий, включая Streptomyces (см., например, [9]). Так, из штамма S.coelicolor A3(2) осуществлено клонирование двух генов, кодирующих активные in vitro и in vivo Ser/Thr-протеинкиназы [10]. Показано также, что белок AfsR, регулирующий биосинтез ряда антибиотиков в S.coelicolor, фосфорилируется по остаткам Ser и Thr [11]. Имеются сообщения об обнаружении протеинкиназных активностей Ser/Thr типа и в других штаммах Streptomyces [12, 13]. Конкретные физиологические и морфологические изменения клеток Streptomyces, обусловленные фосфорилированием по остаткам Ser и Thr, до настоящего времени не выявлены. В связи с этим особое значение приобретают поиск и анализ изменения активностей протеинкиназ Ser/Thr типа в ходе физиологической и морфологической дифференциации прокариот под воздействием различных сигналов и переносчиков информации. Большие возможности для такого анализа представляет наиболее разработанный среди актиномицетов в физиологическом, генетическом и молекулярно-биологическом плане штамм S.lividans, позволяющий сопоставить детально описанные и четко выраженные метаболические и морфологические изменения в ходе дифференциации с изменениями в уровнях активности, спектрах модифицируемых субстратов и чувствительности к модуляторам различных киназ.
Целью настоящей работы явилось выявление протеинкиназной активности Ser/Thr типа в экстрактах клеток культуры S.lividans, находящейся на ранней логарифмической стадии роста, определение чувствительности этой протеинкиназы к различным модуляторам АТР: протеин-фосфотрансфераз и характеристика белковых субстратов, фосфорилируемых ферментом в экстракте. Проводился также сравнительный анализ наборов фосфорилируемых in vitro этой протеинкиназой (или протеинкиназами) белков в экстрактах нескольких штаммов S.lividans, включая ряд штаммов, несущих плазмиды с геном aph VIII (аминогликозидфосфотрансферазы).
Определение Ser/Thr-протеинкиназной активности у актиномицетов проводили в ряду производных штамма S.lividans 66: S.lividans ТК64 (номер в коллекции культур ВКПМ ГНИИГенетика - С-694 [14]); S.lividans 66 pSU10 (V10) с плазмидой pSU10 (3-5 копий на геном) в автономном состоянии (номер ВКПМ С-673 [15]); S.lividans 66 pSU10 (V100) с плазмидой pSU10 в амплифицированном состоянии (номер ВКПМ С-674 [15, 16]). Два последних штамма содержат плазмиды с геном aph VIII, кодирующим аминогликозидфосфотрансферазу, обеспечивающую устойчивость к канамицину на уровне 20 мкг/мл и 5000 мкг/мл соответственно.
Выращивание штаммов проводили в два этапа. На первом этапе 50 мл модифицированной среды YEME (3 г/л дрожжевого экстракта, 5 г/л бакто-пептона, 3 г/л мальтэкстракта, 10 г/л глюкозы, 10 г/л сахарозы, 5 мM MgCl2) засевали споровой суспензией штамма и культивировали в колбе Эрленмейера при 28?С и 260 об/мин в течение 40-48 ч. При выращивании плазмидных штаммов S.lividans: 66 pSU10 (V10) и 66pSU10 (V100) в среду добавляли 5 мкг/мл и 3000 мкг/мл канамицина соответственно. Затем 10 мл выросшего посевного материала переносили в 50 мл свежей среды без антибиотика и выращивали в тех же условиях в течение 13-20 ч (ранняя логарифмическая фаза роста - RG1). Полученную биомассу отделяли низкоскоростным центрифугированием и дважды промывали по 50 мл бесфосфорной среды - 0,1 М трис-HCl, 0,1 М NaCl, 0,04 M KCl, 0,02 M NH4Cl, 0,1 мM CaCl2, 0,16 мM Na2SO4, 1% казаминовых кислот, 1% глюкозы, рН 7,3.
Реактивы: стандартный буфер - 0,01 М триэтаноламин, 0,01 М КCl, 0,125 M NaCl, 0,005 M MgCl2, 0,006 M 2-меркаптоэтанол, 0,001 М ЭДТА, 0,001 М фенилметилсульфонилфторид, 10% глицерина, рН 7,8. В работе использовали АТР ("Merck", Германия) и отечественные [ -32Р]АТР и [ -32Р]АТР и [ -32Р]АТР; гепарин, сАМР, сGМР, фосфатидилсерин, проназу - фирмы "Calbiochem" (США); фенилметилсульфонилфторид, ЭДТА, ЭГТА, РНКазу, додецилсульфат натрия фирмы "Serva" (Германия); меркаптоэтанол и кумасси R250 - "Loba-Chemie" (Австрия); ДНКазу - "Worthington" (США), -32Р]АТР; гепарин, сАМР, сGМР, фосфатидилсерин, проназу - фирмы "Calbiochem" (США); фенилметилсульфонилфторид, ЭДТА, ЭГТА, РНКазу, додецилсульфат натрия фирмы "Serva" (Германия); меркаптоэтанол и кумасси R250 - "Loba-Chemie" (Австрия); ДНКазу - "Worthington" (США),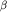 -глицерофосфат, трис-"Fluka" (Германия); полилизин, спермин, фосфоаминокислоты, леупептин и пепстатин - "Sigma" (США). -глицерофосфат, трис-"Fluka" (Германия); полилизин, спермин, фосфоаминокислоты, леупептин и пепстатин - "Sigma" (США).
Протеинкиназную активность определяли в стандартном буфере, содержащем дополнительно 0,1 M NaF и 0,1 M 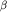 -глицерофосфат, а также по 1 мкг/мл леупептина и пепстатина в присутствии [ -глицерофосфат, а также по 1 мкг/мл леупептина и пепстатина в присутствии [ -32Р]АТР (0,2 мМ, 5000 имп/мин на 1 пмоль) и белков экстракта (20-25 мкг). Объем инкубационной смеси - 100-120 мкл. Реакцию начинали добавлением белков экстракта и проводили в течение 30 мин при температуре 28?С. Реакцию останавливали добавлением 33-40 мкл буфера для приготовления электрофорезных образцов [17] с учетверенной концентрацией всех компонентов, прогревали смесь 5-10 мин при 95?С, диализовали против этого же буфера с нормальной концентрацией компонентов и подвергали электрофорезу. Обработку проназой проводили по окончании реакции фосфорилирования в стандартном буфере с 1% додецилсульфатом натрия и до внесения буфера для электрофорезных образцов в течение 30 мин при температуре 30?С и концентрации проназы 20 мкг/мл. -32Р]АТР (0,2 мМ, 5000 имп/мин на 1 пмоль) и белков экстракта (20-25 мкг). Объем инкубационной смеси - 100-120 мкл. Реакцию начинали добавлением белков экстракта и проводили в течение 30 мин при температуре 28?С. Реакцию останавливали добавлением 33-40 мкл буфера для приготовления электрофорезных образцов [17] с учетверенной концентрацией всех компонентов, прогревали смесь 5-10 мин при 95?С, диализовали против этого же буфера с нормальной концентрацией компонентов и подвергали электрофорезу. Обработку проназой проводили по окончании реакции фосфорилирования в стандартном буфере с 1% додецилсульфатом натрия и до внесения буфера для электрофорезных образцов в течение 30 мин при температуре 30?С и концентрации проназы 20 мкг/мл.
Для приготовления экстрактов биомассу промывали 3 раза по 50 мл стандартного буфера и замораживали в сухом льду с ацетоном. Затем растирали ее в течение 10 мин с двумя весовыми частями пудры окиси алюминия в фарфоровой чашке до сметанообразной консистенции, суспендировали в равном объеме стандартного буфера, содержащего дополнительно по 20 мкг/мл ДНКазы и РНКазы, и удаляли окись алюминия низкоскоростным центрифугированием. Надосадочную жидкость центрифугировали 30 мин при 15000 g и rср 8,5 см на ультрацентрифуге Spinco, L5/50 ("Beckman").Супернатантную фракцию немедленно использовали для анализа протеинкиназной активности.
Одномерный электрофорез в пластине 10% ПААГ в присутствии додецилсульфата натрия проводили по методу Лэммли [17]. В каждый карман геля вносили по 25-30 мкл анализируемого образца. В качестве маркеров использовали смесь белков: миозин из мышцы кролика (205 кДа),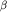 -галактозидазу E.coli (116 кДа), фосфорилазу b (97,4 кДа), БСА (66 кДа), овальбумин (45 кДа), глицеральдегид-3-фосфат-дегидрогеназу из мышцы кролика (36 кДа), карбоангидразу из эритроцитов быка (29 кДа), -галактозидазу E.coli (116 кДа), фосфорилазу b (97,4 кДа), БСА (66 кДа), овальбумин (45 кДа), глицеральдегид-3-фосфат-дегидрогеназу из мышцы кролика (36 кДа), карбоангидразу из эритроцитов быка (29 кДа), -лактальбумин (14 кДа). Гелиокрашивали кумасси R250 в 50% ТХУ в течение 30 мин, отмывали 7% уксусной кислотой и высушивали. При авторадиографии высушенные гели экспонировали с рентгеновской пленкой HS-11 ("ORWO", Германия). Радиоактивность в вырезанных из геля участках измеряли по Черенкову. Содержание белка в препаратах определяли по известным методикам [18, 19]. -лактальбумин (14 кДа). Гелиокрашивали кумасси R250 в 50% ТХУ в течение 30 мин, отмывали 7% уксусной кислотой и высушивали. При авторадиографии высушенные гели экспонировали с рентгеновской пленкой HS-11 ("ORWO", Германия). Радиоактивность в вырезанных из геля участках измеряли по Черенкову. Содержание белка в препаратах определяли по известным методикам [18, 19].
Для идентификации фосфоаминокислот, образующихся в результате фосфорилирования белков экстракта эндогенными протеинкиназами, вырезанные из ПААГ участки с полипептидами гидролизовали при пониженном давлении в 6 М HСl при 110?С в течение 2 ч [20], гидролизованные образцы высушивали на роторном испарителе до полного удаления кислоты и очищали от 32Рi и продуктов гидролиза ПААГ, как описано [21]. Затем образцы подвергали электрофорезу на бумаге Whatman 3MM в 3 М уксусной кислоте, при 5000 В в течение 2,5-3 ч на установке Sаvant (Франция). Электрофореграммы 32Р-содержащих гидролизатов экспонировали с рентгеновской пленкой HS-11 и меченые аминокислоты идентифицировали по их подвижности относительно реперных фосфосерина, фосфотреонина и фосфотирозина, выявляемых после окрашивания нингидрином.
Далее...
Написать комментарий
|

